题目内容
【题目】Na2S2O3在化学定量分析中常用作基准物质,遇酸易分解;实验室制备原理为2Na2S+Na2CO3+4SO2 ![]() 3Na2S2O3+CO2 . 实验装置如下:
3Na2S2O3+CO2 . 实验装置如下: 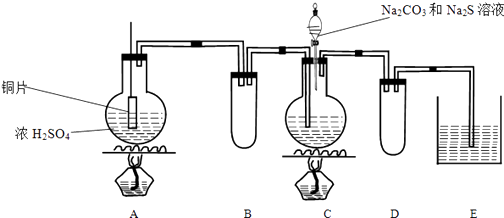
(1)A中发生反应的化学方程式是: .
(2)E中所盛试剂作用是;若要停止A中的化学反应,还可以采取的操作是 .
(3)B和D装置作用:
(4)甲同学在加热A后,发现液面下的铜丝变黑.该同学对黑色生成物提出如下假设:
①可能是CuO;②可能是Cu2O;③可能是CuS
乙同学认为假设②一定不成立,依据是 .
该同学设计实验进一步验证黑色物质的组成:
基于上述假设分析,黑色物质的组成为(填化学式) .
(5)C中通入SO2不能过量原因是 .
(6)实验室用硫代硫酸钠溶液吸收残余氯气生成SO42﹣ , 其反应的离子方程式是:
【答案】
(1)Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+H2O
CuSO4+SO2↑+H2O
(2)吸收尾气防止污染环境;将铜片抽离液面或停止加热
(3)作安全瓶,防止C、E中的溶液倒吸进入A、C中
(4)Cu2O呈砖红色;CuS
(5)硫代硫酸钠在酸性溶液中不稳定易分解
(6)S2O32﹣+5H2O+4Cl2═2SO42﹣+8Cl﹣+10H+
【解析】解:A装置制备二氧化硫,C装置中合成Na2S2O3 , 会导致装置内气压减小,B装置为安全瓶作用,二氧化硫有毒,会污染空气,E装置中可以盛放氢氧化钠溶液吸收剩余的二氧化硫,D装置为安全瓶,防止溶液倒吸.(1)Cu与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫与水,反应方程式为:Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+H2O,
CuSO4+SO2↑+H2O,
所以答案是:Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+H2O;(2)E中所盛试剂作用是:吸收尾气防止污染环境,
CuSO4+SO2↑+H2O;(2)E中所盛试剂作用是:吸收尾气防止污染环境,
若要停止A中的化学反应,还可以采取的操作是:将铜片抽离液面或停止加热,
所以答案是:吸收尾气防止污染环境;将铜片抽离液面或停止加热;(3)B和D装置作用:作安全瓶,防止C、E中的溶液倒吸进入A、C中,
所以答案是:作安全瓶,防止C、E中的溶液倒吸进入A、C中;(4)乙同学认为假设②一定不成立,依据是:Cu2O呈砖红色,设计实验进一步验证黑色物质,黑色固体不溶液硫酸,CuO能与硫酸反应,CuS不溶于硫酸,故黑色物质为CuS,
所以答案是:Cu2O呈砖红色;CuS;(5)二氧化硫过量,会得到亚硫酸,Na2S2O3遇酸易分解,故二氧化硫不能过量,
所以答案是:硫代硫酸钠在酸性溶液中不稳定易分解;(6)用硫代硫酸钠溶液吸收残余氯气生成SO42﹣ , 氯气被还原为氯离子,反应离子方程式为:S2O32﹣+5H2O+4Cl2═2SO42﹣+8Cl﹣+10H+ ,
所以答案是:S2O32﹣+5H2O+4Cl2═2SO42﹣+8Cl﹣+10H+ .

