��Ŀ����
����Ŀ�����ӹ�ҵ����30%��FeCl3��Һ��ʴ���ھ�Ե���ϵ�ͭ��������ӡˢ��·�塣
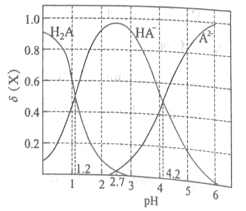
��1��������Һ��Fe3�����ڵ��Լ���__________����ַ�Ӧ��֤����Һ��ֻ����Fe2����������Fe3����������__________________��
��2��д��FeCl3��Һ�����ͭ������Ӧ�Ļ�ѧ����ʽ��______________________��
��3��ij����ʦΪ�˴�ʹ�ù��ĸ�ʴ��Һ�л���ͭ�������»��FeCl3��Һ�����������в��裺
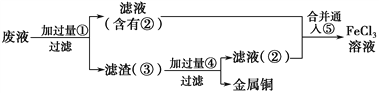
�������۵���Ҫ�ɷ��ǣ�__________����Һ�ڵ���Ҫ�ɷ��ǣ�__________��
������һ����������Ϊ�ݵ��Լ�����__________��
A��Cl2 B��O2 C��H2O2 D��KMnO4
��д����Ӧ�ܵ����ӷ���ʽ��___________________________________��
���𰸡� KSCN �ȼ�KSCN��Һ�����Ա仯���ټ���H2O2����ˮ����Һ��Ѫ��ɫ����˵���� 2FeCl3+Cu==2FeCl2+CuCl2 Cu��Fe FeCl2 D Fe + Cu2+= Fe2++ Cu
��������(1)������Һ��Fe3������ͨ����KSCN��Һ��ȡ������Һ���μ�KSCN��Һ����Һ���˵��Fe3�����ڣ���ַ�Ӧ��֤����Һ��ֻ����Fe2����������Fe3���������ǣ��ȼ�KSCN��Һ�����Ա仯���ټ���H2O2����ˮ����Һ��Ѫ��ɫ����˵����Fe2������2��ͭ���Ȼ�����Ӧ�����Ȼ������Ȼ���������Ӧ����ʽΪ2FeCl3+Cu�T2FeCl2+CuCl2�����ӷ���ʽΪ2Fe3��+Cu=2Fe2��+Cu2������3���ɹ������̿�֪��Cu��FeCl3����Cu+2FeCl3=2FeCl2+2CuCl2����Һ�к���Cu2����Fe2�������ܺ���Fe3�������Һ�м���Fe�ۣ�����Cu2��+Fe=Fe2��+Cu�����ˣ������к���Fe��Cu����Һ�к���FeCl2���������м������ϡ���ᣬ����Fe+2HCl=FeCl2+H2����Ȼ����ˣ��õ���������Cu����Һ�к���HCl��FeCl2������Һ�ڢݻ�ϣ�Ȼ��ͨ��Cl2��������Ӧ2FeCl2+Cl2=2FeCl3�����Եõ��Ȼ�����Һ���������۵���Ҫ�ɷ��ǣ�Cu��Fe����Һ�ڵ���Ҫ�ɷ��� FeCl2����KMnO4��Fe2����Ӧ�����Mn2��,���������ʣ�һ����������Ϊ�ݵ��Լ�����D��KMnO4����д����Ӧ�ܵ����ӷ���ʽ Fe + Cu2+= Fe2++ Cu��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ������ѧһѡ��3�����ʽṹ�����ʡ�
ijԭ�Ͼ��ⶨ��Ҫ����A��B��C��D��E����ԭ���������������ǰ������Ԫ�أ��������Ϣ���£�
Ԫ�� | Ԫ�����ʻ�ԭ�ӽṹ |
A | ���ڱ���ԭ�Ӱ뾶��С��Ԫ�� |
B | ԭ�Ӻ��������ֲ�ͬ���ܼ��Ҹ����ܼ������ĵ�������ͬ |
C | �����p�������� |
D | λ�ڶ����ڣ���ԭ�ӵĺ���ɶԵ�������δ�ɶԵ�������3�� |
E | λ��ds����ԭ�ӵ�������������A����ͬ |
��ش���������(��A��B��C��D��E����Ӧ��Ԫ�ط�������)��
(1) B��C��D��һ�������ɴ�С��˳��Ϊ_____��
(2) E�Ķ������ӵĵ����Ų�ʽΪ_____��
(3) A2B2D4��������������÷�����B���ӻ���ʽΪ_____��1 mol A2B2D4�����к��ЦҼ���м�����Ŀ֮��Ϊ_____��
(4) �뻯����BD��Ϊ�ȵ�����������ӵĻ�ѧʽΪ_____(��дһ��)��
(5) B2A6��C2A4�����о�����18�����ӣ����ǵķе����ϴ���Ҫԭ����___��
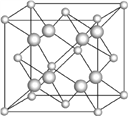
(6) һ��E�ͽ�Au���γɵĺϽ�����������������ܶѻ��ṹ���侧����Eԭ�Ӵ������ģ�Auԭ�Ӵ��ڶ��㣬��úϽ���Eԭ����Auԭ�ӵĸ���֮��Ϊ___������������Auԭ�ӵ���̾���Ϊa���ף���úϽ���ܶ�Ϊ_____g/cm3����֪����������д���ܣ���ԭ�ӿɽ��뵽��Eԭ����Auԭ�ӹ��ɵ��������϶�С�����Eԭ����Auԭ�ӵ�ͬ�������þ��崢���ľ����ṹ��CaF2(��ͼ)�Ľṹ���ƣ��þ��崢���Ļ�ѧʽӦΪ_____��
����Ŀ���״���һ�ֻ���ԭ�ϣ��ڹ�ҵ����������Ҫ��Ӧ�á�
��.��l.0L�����ܱ�������Ͷ��1 molCO2��2.75molH2������Ӧ��
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)��ʵ���ò�ͬ�¶ȼ�ѹǿ�£�ƽ��ʱ�״������ʵ����仯��ͼ��ʾ������˵����ȷ����_______��
CH3OH(g)+H2O(g)��ʵ���ò�ͬ�¶ȼ�ѹǿ�£�ƽ��ʱ�״������ʵ����仯��ͼ��ʾ������˵����ȷ����_______��

A���÷�Ӧ������ӦΪ���ȷ�Ӧ
B��ѹǿ��С��ϵΪpl<p2<p3
c. M���Ӧ��ƽ�ⳣ��K��ֵԼΪ1.04��10-2
D.��p2��512Kʱ��ͼ��N��v��������v���棩
��.�״��ǻ����л�����ԭ�ϡ��״�������ƵõIJ�Ʒ�ķе����¡�
���� | �״� | ���װ� | ���������� | ���� | ̼������� |
�ṹ��ʽ | CH3OH | (CH3)2NH | (CH3)2NCHO | CH3OCH3 | (CH3O)2CO |
�е�/�� | 64.7 | 7.4 | 153 | -24.9 | 90 |
��1����425�桢Al2O3���������״��백����Ӧ�����Ƶö��װ������װ��������ԣ������ᷴӦ����(CH3)2NH2Cl����Һ�и�����Ũ���ɴ�С��˳��Ϊ____________��
��2���״��Ƽ��ѵĻ�ѧ����ʽΪ2CH3OH![]() CH3OCH3+H2O��һ���¶��£������Ϊ1.0L�ĺ����ܱ������з����÷�Ӧ����֪387��ʱ�÷�Ӧ�Ļ�ѧƽ�ⳣ��K=4������ʼʱ������I�г���0.10molCH3OH��0.15molCH3OCH3��0.10molH2O����Ӧ����______����������桱����Ӧ������С�
CH3OCH3+H2O��һ���¶��£������Ϊ1.0L�ĺ����ܱ������з����÷�Ӧ����֪387��ʱ�÷�Ӧ�Ļ�ѧƽ�ⳣ��K=4������ʼʱ������I�г���0.10molCH3OH��0.15molCH3OCH3��0.10molH2O����Ӧ����______����������桱����Ӧ������С�
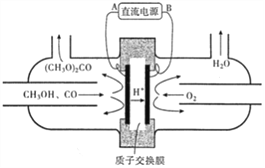
��3���Լ״�Ϊ��Ҫԭ�ϣ��绯ѧ�ϳ�̼��������Ĺ���ԭ������ͼ��ʾ��
��Դ�ĸ���Ϊ__________���A����B������д�������ĵ缫��Ӧ_________�����μӷ�Ӧ��O2Ϊ1.12m3����״���������Ƶõ�̼�������������Ϊ______kg��