题目内容
 二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示.常温下,S2Cl2遇水易水解,并产生能使品红溶液褪色的气体.下列说法错误的是( )
二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示.常温下,S2Cl2遇水易水解,并产生能使品红溶液褪色的气体.下列说法错误的是( )分析:A、S2Cl2遇水易水解,并产生能使品红溶液褪色的气体,该气体为二氧化硫,在反应过程中硫元素一部分升高到+4价(生成SO2),一部分降低到0价(生成S),符合氧化还原反应原理.
B、同种元素原子之间形成非极性键,不同元素的原子之间形成的化学键多为极性键.
C、组成与结构相似,相对分子质量越大,其熔沸点越高.
D、氯原子未成键的孤对电子对未标出.
B、同种元素原子之间形成非极性键,不同元素的原子之间形成的化学键多为极性键.
C、组成与结构相似,相对分子质量越大,其熔沸点越高.
D、氯原子未成键的孤对电子对未标出.
解答:解:A、S2Cl2中的硫元素为中间价态(+1价),在反应过程中一部分升高到+4价(生成SO2),一部分降低到0价(生成S),符合氧化还原反应原理,故A正确;
B、S2Cl2的结构类似于H2O2的结构,为Cl-S-S-Cl,其中的S-S为非极性键,S-Cl键为极性键,故B正确;
C、S2Br2与S2Cl2的组成与结构相似,相对分子质量越大,范德华力越大,其熔沸点越高,所以熔沸点S2Br2>S2Cl2,故C正确;
D、氯原子未成键的孤对电子对未标出,S2Cl2的电子式为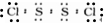 ,故D错误.
,故D错误.
故选:D.
B、S2Cl2的结构类似于H2O2的结构,为Cl-S-S-Cl,其中的S-S为非极性键,S-Cl键为极性键,故B正确;
C、S2Br2与S2Cl2的组成与结构相似,相对分子质量越大,范德华力越大,其熔沸点越高,所以熔沸点S2Br2>S2Cl2,故C正确;
D、氯原子未成键的孤对电子对未标出,S2Cl2的电子式为
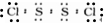 ,故D错误.
,故D错误.故选:D.
点评:以S2Cl2的结构为载体,考查分子结构、化学键、电子式、氧化还原反应、分子间作用力与物质性质等,难度不大,是对基础知识的综合运用与学生能力的考查,注意基础知识的全面掌握,是一道不错的能力考查题目.

练习册系列答案
相关题目