题目内容
【题目】二甲醚是一种重要的化工原料,利用水煤气(CO、H2)合成二甲醚是工业上的常用方法,该方法由以下几步组成: 2H2(g)+CO(g)CH3OH(g)△H=﹣90.0kJmol﹣1①
2CH3OH(g)CH3OCH3(g)+H2O(g)△H=﹣24.5kJmol﹣1②
CO(g)+H2O(g)CO2(g)+H2(g)△H=﹣41.1kJmol﹣1③
(1)下列说法正确的是
A.反应①的△S<0、△H<0,所以能在较低温度下自发进行.
B.反应③的H2O与CO的生成速率之比为1:1时,表示该反应已经达到平衡状态
C.反应②属于加成反应
(2)反应①合成的甲醇在工业上可以用作燃料电池,请写出甲醇燃料电池(KOH溶液)负极电极反应式 .
(3)当合成气中CO与H2的物质的量之比恒定时,温度、压强对CO转化率影响如图1所示,图1中A点的v(逆)B点的v(正)(填“>”、“<”或“=”),说明理由 . 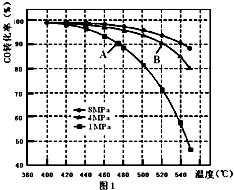
(4)一定温度下,密闭容器中发生反应③,该反应的平衡常数表达式k=;水蒸气的转化率与 ![]() 的关系如图2,计算该温度下反应③的平衡常数K= .
的关系如图2,计算该温度下反应③的平衡常数K= . 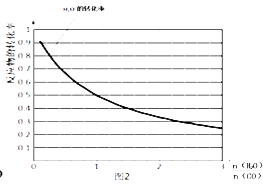
【答案】
(1)A
(2)CH3OH+8OH﹣﹣6e﹣═CO32﹣+6H2O
(3)<;B点对应的温度和压强都比A点高,温度升高,或压强增大,都会加快反应速率
(4)![]() ;1
;1
【解析】解:(1)A、反应①的△S<0、△H<0,根据△G=△H﹣T△S判断:在较低温度下自发进行,A正确;B、反应进行到任何时候H2O与CO的生成速率之比都为1:1,B错误;
C、反应②属于取代反应,C错误;
所以答案是:A;(2)燃料电池中,负极上甲醇失电子发生氧化反应,电极反应式为:CH3OH﹣6e﹣+8OH﹣=CO32﹣+6H2O;
所以答案是:CH3OH+8OH﹣﹣6e﹣═CO32﹣+6H2O;(3)B点对应的温度和压强都比A点高,温度升高,或压强增大,都会加快反应速率,故A点的v(逆)<B点的v(正);
所以答案是:<;B点对应的温度和压强都比A点高,温度升高,或压强增大,都会加快反应速率;(4)CO(g)+H2O(g)CO2(g)+H2(g)的K= ![]() ;
;
由图可知, ![]() =1时水的转化率为0.5,令水、CO的起始物质的量均为1mol,转化的水为0.5mol,则:
=1时水的转化率为0.5,令水、CO的起始物质的量均为1mol,转化的水为0.5mol,则:
CO(g)+ | H2O(g) | CO2(g)+ | H2(g) | ||
起始量(mol): | 1 | 1 | 0 | 0 | |
变化量(mol): | 0.5 | 0.5 | 0.5 | 0.5 | |
平衡量(mol): | 0.5 | 0.5 | 0.5 | 0.5 |
由于反应前后气体物质的量不变,用物质的量代替浓度计算平衡常数,则平衡常数K= ![]() =1;
=1;
所以答案是: ![]() ;1.
;1.
【考点精析】利用反应热和焓变和化学平衡的计算对题目进行判断即可得到答案,需要熟知在化学反应中放出或吸收的热量,通常叫反应热;反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.

 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案