题目内容
【题目】为了比较温室效应气体对目前全球增温现象的影响,科学家通常引用“温室效应指数”,以二氧化碳为相对标准。表1有(A)至(I)共九种气体在大气中的体积百分比及其温室效应指数。结合表中列出的九种气体,试参与回答下列各题:

(1)下列由极性键形成的极性分子是 。
A.N2 B.O2 C.H2O D.CO2 E.CH4
(2)下列说法不正确的是 。
A.N2O与CO2,CCl3F与CCl2F2互为等电子体
B.CCl2F2无同分异构体,说明其中碳原子采用sp3方式杂化
C.CH4是目前引起温室效应的主要原因
D.H2O沸点是九种物质中最高的,是因为水分子间能形成氢键
(3)在半导体生产或灭火剂的使用中,会向空气逸散气体如:NF3.CHClFCF3.C3F8,它们虽是微量的,有些确是强温室气体,下列推测不正确的是 。
A.由价层电子对互斥理论可确定NF3分子呈三角锥形
B.C3F8在CCl4中的溶解度比水中大
C.CHClFCF3存在手性异构
D.第一电离能:N<O<F
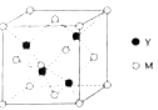
(4)甲烷晶体的晶胞结构如图,下列有关说法正确的是 。

A.甲烷在常温下呈气态,说明甲烷晶体属于分子晶体
B.晶体中1个CH4分子有12个紧邻的甲烷分子
C. CH4晶体熔化时需克服共价键
D.可燃冰(8CH4·46H2O)是在低温高压下形成的晶体
(5)中钴离子在基态时核外电子排布式为:
【答案】
(1)C
(2) C
(3)D
(4)ABD
(5)1s22s22p63s23p63d6
【解析】
试题分析:(1)N2、O2 不含极性键,为非极性分子,H2O、CO2、CH4都含有极性键,H2O为V型,分子不对称,为极性分子,CO2为直线型、CH4为正四面体型,为对称结构,属于非金属性分子。
故答案为:C;
(2)A.N2O与CO2原子总数相等且电子总数相等,二者为等电子体,CCl3F与CCl2F2原子总数相等且价电子总数,二者互为等电子体,故A正确;B.CCl2F2无同分异构体,说明分子为四面体结构,碳原子采用sp3方式杂化,故B正确;C.目前引起温室效应的主要原因是二氧化碳,不是甲烷,故C错误;D.9种物质都属于分子晶体,H2O分子之间存在氢键,9种物质中水沸点最高,故D正确。
故答案为:C;
(3)A.NF3分子中N原子价层电子对数=3+![]() =4、有1对孤电子对,故其为三角锥型空间构型,故A正确;B.C3F8属于有机物,易溶于有机溶剂,C3F8在CCl4中的溶解度比水中大,故B正确;C.CHClFCF3分子中存在手性碳原子(连接H原子的碳原子),故存在手性异构,故D正确;D.同周期自左而右元素第一电离能呈增大趋势,但N元素2p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能O<N<F,故D错误。
=4、有1对孤电子对,故其为三角锥型空间构型,故A正确;B.C3F8属于有机物,易溶于有机溶剂,C3F8在CCl4中的溶解度比水中大,故B正确;C.CHClFCF3分子中存在手性碳原子(连接H原子的碳原子),故存在手性异构,故D正确;D.同周期自左而右元素第一电离能呈增大趋势,但N元素2p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能O<N<F,故D错误。
故答案为:D;
(4)A.甲烷在常温下呈气态,说明甲烷沸点很低,晶体属于分子晶体,故A正确;B.以顶点甲烷分子为研究对象,与之最近的甲烷分子位于面心,每个甲烷分子为12个面共用,故晶体中1个CH4分子有12个紧邻的甲烷分子,故B正确;C.CH4晶体属于分子晶体,熔化时需克服分子间作用力,故C错误;D.常温下甲烷为气态、水为液态,形成可燃冰(8CH446H2O)晶体的条件应是低温高压,故D正确。
故答案为:ABD;
(6)上述(5)中钴离子为Co3+,离子核外电子数为24,其核外电子排布为:1s22s22p63s23p63d6。
故答案为:1s22s22p63s23p63d6。