题目内容
下列溶液中可能含有(1)若滴入溴水后,溶液由无色变成棕黄色,并出现浑浊,则溶液中一定含有 。
(2)若加入硝酸钡溶液,有白色沉淀生成,再加入盐酸,沉淀少部分溶解,原溶液中一定含有 。
(3)若加入氯化钡溶液及盐酸的混合溶液无沉淀生成。若先加氯水,然后再加入氯化钡溶液和盐酸,有白色沉淀生成,则原溶液中一定含有 。
(4)若加入氢氧化钡无沉淀生成,加入硝酸银溶液也无沉淀生成,则原溶液中阴、阳离子只可能是 。
解析:离子存在的情况决定了所加试剂及产生的现象。
(1)滴入溴水后溶液由无色变为棕黄色并出现浑浊,溶液一定含有I-,I-被Br2氧化为单质,2I-+Br2 ![]() I2+2Br-,故溶液变为棕黄色。
I2+2Br-,故溶液变为棕黄色。
出现浑浊是由于S2-被氧化为单质S出现沉淀,S2-+Br2 ![]() 2Br-+S↓,所以也一定含有S2-。
2Br-+S↓,所以也一定含有S2-。
因为有阴离子就必须有与之相应的阳离子,故必有Na+。
(2)加入硝酸钡有白色沉淀生成,现加入盐酸,沉淀少部分溶解,则溶液中必含有![]() ,生成BaSO4不溶于水,不溶于酸;也一定含有
,生成BaSO4不溶于水,不溶于酸;也一定含有![]() ,生成BaSO3沉淀,不溶于水,可溶于酸。
,生成BaSO3沉淀,不溶于水,可溶于酸。
同样该溶液中必含阳离子。由于Na2SO4、Na2SO3、MgSO4可溶于水,而MgSO3微溶于水,可能形成沉淀,Mg2+与![]() 不能大量共存,故此溶液中必含Na+。
不能大量共存,故此溶液中必含Na+。
(3)若在溶液中加入氯化钡和盐酸的混合溶液,无沉淀生成。先加入氯水,然后再加入氯化钡溶液及盐酸,有白色沉淀产生。该溶液中必含![]() ,因为在酸性条件下不可能生成BaSO3沉淀,而加入氯水后,
,因为在酸性条件下不可能生成BaSO3沉淀,而加入氯水后,![]() 被氧化为
被氧化为![]() :
:
![]() +Cl2+H2O
+Cl2+H2O ![]()
![]() +2H++2Cl-
+2H++2Cl-
故再加入氯化钡溶液及盐酸将产生不溶于酸的白色沉淀BaSO4。该溶液中的阳离子应为Na+,因为Mg2+与![]() 不能大量共存。
不能大量共存。
(4)若加入Ba(OH)2溶液无沉淀,则溶液中无![]() 、
、![]() 、Mg2+,若加入AgNO3无沉淀,则溶液中无Cl-、Br-、I-、
、Mg2+,若加入AgNO3无沉淀,则溶液中无Cl-、Br-、I-、![]() 、
、![]() 等离子,所以溶液中只可能存在Na+和
等离子,所以溶液中只可能存在Na+和![]() 。
。
答案:(1)Br-、S2-、Na+
(2) ![]() 、
、![]() 、Na+
、Na+
(3) ![]() 、Na+
、Na+
(4)Na+、![]()

 春雨教育同步作文系列答案
春雨教育同步作文系列答案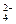 、SO
、SO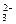 、S2-、Cl-、Br-、I-、NO
、S2-、Cl-、Br-、I-、NO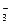 、Na+、Mg2+等离子.
、Na+、Mg2+等离子.