题目内容
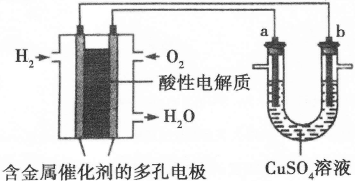
如下图装置所示,是用氢氧燃料电池B进行的某电解实验:
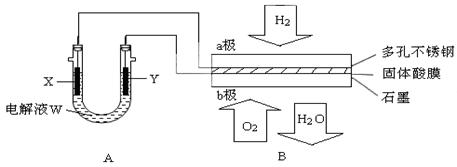
(1)若电池B使用了亚氨基锂(Li2NH)固体作为储氢材料,其储氢原理是:
Li2NH+H2=LiNH2+LiH ,则下列说法中正确的是 。
(2)在电池B工作时:
① 若用固体Ca(HSO4)2为电解质传递H+,则电子由 极流出,H+向 极移动。(填“a”或“b ”)
② b极上的电极反应式为:
③ 外电路中,每转移0.1 mol电子,在a极消耗 L的H2(标准状况下)。
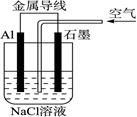
(3)若A中X、Y都是惰性电极,电解液W是滴有酚酞的饱和NaCl溶液,则B工作时:
① 电解池中X极上的电极反应式是 。在X极这边观察到的现象是 。
② 检验Y电极上反应产物的方法是 。
③ 若A中其它均不改变,只将电极Y换成铁棒,可实现的实验目的是 。

(1)若电池B使用了亚氨基锂(Li2NH)固体作为储氢材料,其储氢原理是:
Li2NH+H2=LiNH2+LiH ,则下列说法中正确的是 。
| A.Li2NH中N的化合价是-1 |
| B.该反应中H2既是氧化剂又是还原剂 |
| C.Li+和H+的离子半径相等 |
| D.此法储氢和钢瓶储氢的原理相同 |
① 若用固体Ca(HSO4)2为电解质传递H+,则电子由 极流出,H+向 极移动。(填“a”或“b ”)
② b极上的电极反应式为:
③ 外电路中,每转移0.1 mol电子,在a极消耗 L的H2(标准状况下)。
(3)若A中X、Y都是惰性电极,电解液W是滴有酚酞的饱和NaCl溶液,则B工作时:
① 电解池中X极上的电极反应式是 。在X极这边观察到的现象是 。
② 检验Y电极上反应产物的方法是 。
③ 若A中其它均不改变,只将电极Y换成铁棒,可实现的实验目的是 。
(1)B(2)①a,b ② O2 + 4H+ + 4e- = 2H2O ③ 1.12(3)① 2H++2e- = H2↑,溶液变红 ② 用润湿的KI淀粉试纸接近Y极气体产物,变蓝,证明产生Cl2气 ③ 制Fe(OH)2
试题分析:(1)A、Li2NH中N的化合价为-3价,故A错误;B、反应中H2分别生成LiNH2和LiH,LiNH2中H为+1价,LiH中H的化合价为-1价,反应中H2既是氧化剂又是还原剂,故B正确C、LiH中的阳离子和阴离子核外电子排布相同,核电核数越大,半径越小,则阳离子半径小于阴离子半径,故C错误;D、此法储氢是利用氧化还原反应将H2转化为固体材料,发生化学变化,而钢瓶储氢将氢液化,为物理变化,原理不同,故D错误(2)①通入氢气的电极为电池的负极,发生氧化还原反应,反应为H2-2e-═2H+,通入氧气的电极为电池的正极,发生氧化反应,反应为O2+4e-+4H+=2H2O;电池工作时,电子通过外电路从负极流向正极,即从a极流向b极,电解质溶液中阳离子向正极移动,即H+由a极通过固体酸电解质传递到b极②b极为正极,发生氧化反应,电极反应O2+4e-+4H+=2H2O③转移电荷守恒,由题意知每转移2mol电子消耗1mol H2,即每转移0.1mol电子,在a极消耗0.05mol H2,即1.12L H2(3)由题意知,a端为电源负极,b端为电源正极①电解饱和食盐水中和电源的负极a端相连的电极X极是阴极,该电极上氢离子发生得电子的还原反应,即2H++2e-=H2↑,溶液中H+离子浓度减小,碱性增强,酚酞变红②和电源的正极相连的电极Y极是阳极,该电极上氯离子发生失电子的氧化反应,即2Cl--2e-=Cl2↑生成产物为氯气,检验方式为用润湿的KI淀粉试纸接近Y极气体产物,变蓝,证明产生Cl2气③Y极发生失去电子的氧化反应化合价升高,铁生成亚铁离子,溶液中有大量氢氧根离子和亚铁离子结合生成氢氧化亚铁沉淀,故其目的为制Fe(OH)2。

练习册系列答案
相关题目