题目内容
下列溶液中,离子浓度的关系一定正确的是( )
| A、氨水中逐滴加入盐酸得到酸性溶液:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| B、pH相同的CH3COONa溶液、Ba(OH)2溶液、KHCO3溶液:c(K+)>c(Na+)>c(Ba2+) |
| C、物质的量浓度相等Na2CO3和NaHCO3溶液等体积混合:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) |
| D、将等物质的量的KHC2O4和H2C2O4溶于水配成溶液:2c(K+)=c(HC2O4-)+c(H2C2O4) |
考点:离子浓度大小的比较
专题:盐类的水解专题
分析:A.当氨水的物质的量很小是,溶液中离子浓度可能为c(H+)>c(NH4+);
B.醋酸钠和碳酸氢钾都是强碱弱酸盐,氢氧化钡为强碱,根据盐的水解原理判断各离子浓度大小;
C.碳酸根离子的水解程度大于碳酸氢根离子,溶液显示碱性,则c(HCO3-)>c(CO32-)、c(OH-)>c(H+);
D.根据KHC2O4和H2C2O4的混合液中物料守恒进行判断.
B.醋酸钠和碳酸氢钾都是强碱弱酸盐,氢氧化钡为强碱,根据盐的水解原理判断各离子浓度大小;
C.碳酸根离子的水解程度大于碳酸氢根离子,溶液显示碱性,则c(HCO3-)>c(CO32-)、c(OH-)>c(H+);
D.根据KHC2O4和H2C2O4的混合液中物料守恒进行判断.
解答:
解:A.当得到的是氯化铵溶液时,离子浓度大小关系是c(Cl-)>c(NH4+)>c(H+)>c(OH-),当盐酸的物质的量远远大于氨水的物质的量时,离子浓度大小关系是c(Cl-)>c(H+)>c(NH4+)>c(OH-),故A错误;
B.pH相同,说明CH3COONa溶液、Ba(OH)2溶液、KHCO3溶液中氢氧根离子浓度相同,氢氧化钡为强碱,则钡离子浓度最小;醋酸的酸性大于碳酸,则醋酸根的水解程度小于碳酸氢钾,若要满足水解生成的氢氧根离子浓度相等,则醋酸钠的浓度大于碳酸氢钾溶液的浓度,即c(K+)<c(Na+),离子之间浓度大小为:c(Na+)>c(K+)>c(Ba2+),故B错误;
C.物质的量浓度相等Na2CO3和NaHCO3溶液等体积混合,由于碳酸根离子的水解程度大于碳酸氢根离子,溶液显示碱性,则c(HCO3-)>c(CO32-)、c(OH-)>c(H+),则溶液中离子浓度大小为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),故C正确;
D.等物质的量的KHC2O4和H2C2O4溶于水配成溶液,草酸为弱酸,HC2O4-能够电离出C2O42-,根据混合液中的物料守恒可知:2c(K+)=c(C2O42-)+c(HC2O4-)+c(H2C2O4),故D错误;
故选C.
B.pH相同,说明CH3COONa溶液、Ba(OH)2溶液、KHCO3溶液中氢氧根离子浓度相同,氢氧化钡为强碱,则钡离子浓度最小;醋酸的酸性大于碳酸,则醋酸根的水解程度小于碳酸氢钾,若要满足水解生成的氢氧根离子浓度相等,则醋酸钠的浓度大于碳酸氢钾溶液的浓度,即c(K+)<c(Na+),离子之间浓度大小为:c(Na+)>c(K+)>c(Ba2+),故B错误;
C.物质的量浓度相等Na2CO3和NaHCO3溶液等体积混合,由于碳酸根离子的水解程度大于碳酸氢根离子,溶液显示碱性,则c(HCO3-)>c(CO32-)、c(OH-)>c(H+),则溶液中离子浓度大小为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),故C正确;
D.等物质的量的KHC2O4和H2C2O4溶于水配成溶液,草酸为弱酸,HC2O4-能够电离出C2O42-,根据混合液中的物料守恒可知:2c(K+)=c(C2O42-)+c(HC2O4-)+c(H2C2O4),故D错误;
故选C.
点评:本题考查了溶液中离子浓度大小判断,题目难度中等,注意掌握盐的水解原理,能够根据电荷守恒、物料守恒、盐的水解原理比较溶液中各离子之间浓度大小.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
乙醇分子内脱水的反应属于( )
| A、加聚反应 | B、取代反应 |
| C、加成反应 | D、消去反应 |
强热绿矾晶体,除结晶水蒸发外,还发生如下化学反应:2FeSO4
Fe2O3+SO2↑+SO3↑.如果将生成的气体通入浓BaCl2溶液中,产生的现象是( )
| ||
| A、生成确BaSO4和BaSO3混合沉淀 |
| B、生成BaSO4沉淀,有SO2气体逸出 |
| C、生成BaSO4沉淀,有SO3气体逸出 |
| D、有SO2和SO3两种气体同时逸出 |
化学源于生活,同时又服务于生活,下列说法不合理的是( )
| A、田间焚烧秸秆污染环境,浪费资源 |
| B、泄露在海洋中的大量原油能被海洋生物迅速分解,不会导致生态灾难,不需要治理 |
| C、推广使用无磷洗涤剂,可有效减少水体的富营养化 |
| D、服用铬含量超标的药用胶囊会对从体健康造成危害 |
焰色反应时,使用的铂丝每次蘸待测液之前都要( )
| A、用滤纸擦干净 |
| B、多次用水洗 |
| C、在酒精灯火焰上烧 |
| D、用稀盐酸洗涤,再灼烧至火焰呈无色为止 |
向澄清饱和石灰水中放入一小块钠,不可能出现的现象是( )
| A、钠熔化成光亮银白色的小球 |
| B、浮在液面快速游动 |
| C、液体底部出现银白色固体 |
| D、液面有水雾 |
元素周期表中有三组元素:Li与Mg、Be(铍)与Al、B与Si的单质及其化合物很多理化性质相似,称为“对角线规则”.由此判断下列说法不正确的是( )
| A、Li2CO3受热分解生成Li2O和CO2 |
| B、Be、BeO和Be(OH)2既能与NaOH(aq)反应又能HCl(aq)反应 |
| C、单质硼的熔沸点高、硬度大,属于原子晶体 |
| D、Li、Be和B三种单质及其化合物化学性质都相似 |
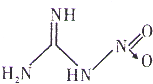 硝基胍是硝化纤维火药、硝化甘油火药的掺合剂、固体火箭推进剂的重要组分,其结构如图所示(“→”是一种特殊的共价单键).下列有关硝基胍的说法正确的是( )
硝基胍是硝化纤维火药、硝化甘油火药的掺合剂、固体火箭推进剂的重要组分,其结构如图所示(“→”是一种特殊的共价单键).下列有关硝基胍的说法正确的是( )| A、硝基胍分子中只含极性键,不含非极性键 |
| B、硝基胍中有C、H、O、N四种元素,属于氨基酸 |
| C、硝基胍分子中σ键与π键的个数比是5:1 |
| D、10.4 g该物质含有11×6.02×1023个原子 |
分子组成为C9H12的苯的同系物,已知苯环上只有一个取代基,下列说法中正确的是( )
| A、该有机物不能使酸性高锰酸钾溶液褪色,但能使溴水褪色 |
| B、该有机物分子中的所有原子可能在同一平面上 |
| C、该有机物的一溴代物最多有6种同分异构体 |
| D、该有机物不能发生加成反应,但能发生取代反应 |