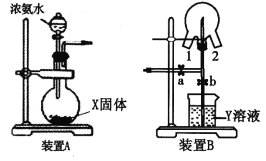
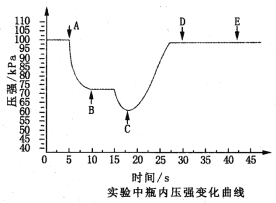
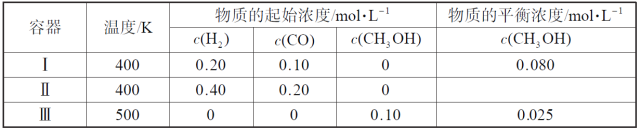
��Ŀ����
����Ŀ������������NaClO2������Һ�п�����ClO2��HClO2��ClO2����Cl����������HClO2��ClO2������Ư����������ClO2���ж����塣ij�¶��£����ֺ�����ֺ�����pH�仯�����ͼ��ʾ������˵������ȷ����
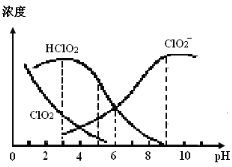
A��ʹ�ø�Ư��������pHԼΪ5.0
B�����¶���NaClO2��Һ����c(Na��)��c(ClO2��)��c(OH��)��c(H��)
C�����¶���HClO2�ĵ���ƽ�ⳣ������ֵKa��1.0��10��6
D����ͬpH��NaClO2��Һ�д������й�ϵ��c(Na��)= c(ClO2��)+ c(HClO2)+ c(ClO2)
���𰸡�D
��������
���������A��pHԼΪ5.0ʱClO2�����ͣ�HClO2�����ϸߣ���A��ȷ��B��NaClO2��ǿ�������Σ�ˮ��ʼ��ԣ�c(Na��)��c(ClO2��)��c(OH��)��c(H��)����B��ȷ��C��pH=6ʱ��HClO2��ClO2��Ũ����ȣ�HClO2�ĵ���ƽ�ⳣ�� =1.0��10��6����C��ȷ��D�����������غ�c(Na��)= c(ClO2��)+ c(HClO2)+ c(ClO2)+ c(Cl��)����D����
=1.0��10��6����C��ȷ��D�����������غ�c(Na��)= c(ClO2��)+ c(HClO2)+ c(ClO2)+ c(Cl��)����D����

��ϰ��ϵ�д�
 ��ĩ1�����ʽ���������ϵ�д�
��ĩ1�����ʽ���������ϵ�д�
�����Ŀ