题目内容
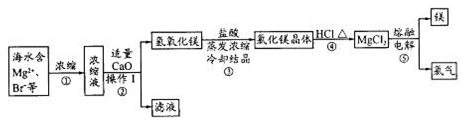
从海带中提取碘的实验过程中,下列正确的操作是
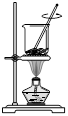







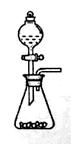
| A.海带灼烧成灰 | B.过滤含I-溶液 | C.放出碘的苯溶液 | D.分离碘并回收苯 |
D
试题分析:海带是固体可燃物,不能在烧杯中灼烧,应该在坩埚中灼烧成灰,故A错;过滤时需要玻璃棒引流,不能直接倒入漏斗,故B错;碘单质易溶于苯,不会分层,不能用分液漏斗分离,故C错;苯的沸点比碘低得多,通过水浴加热蒸馏可以将碘的苯溶液中的苯分离出来,同时防止碘升华,故D正确。

练习册系列答案
相关题目