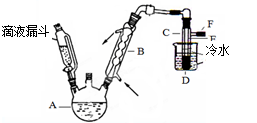
题目内容
常温下将甲烷与O2混合气体57ml点燃,充分燃烧后恢复原来状态,剩余气体为23ml,试计算混合气体的组成。
甲烷 17ml; O2 40ml或甲烷 23ml; O2 34ml,
试题分析:解:设参加反应的甲烷和氧气的体积分别x、y,
CH4+2O2
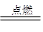 CO2+2H2O △V
CO2+2H2O △V1 2 1 2
x y 57-23=34mL
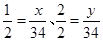
所以x=17mL,
所以y=34mL,
由于17mL+34mL=51mL<57mL,剩余气体为57mL-51mL=6mL,若剩余的气体为甲烷,则甲烷 23ml; O2 34ml,若剩余气体有氧气,则甲烷 17ml; O2 40ml。
点评:本题考查了利用化学方程式进行的相关计算,本题要注意在甲烷与氧气反应的,若有气体剩余只能有一种气体剩余,不能两种气体都剩余,所以甲烷和氧气的体积有两种可能,本题有难度中等。

练习册系列答案
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案
相关题目