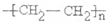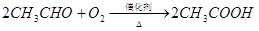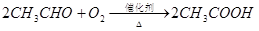题目内容
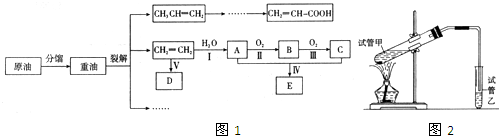
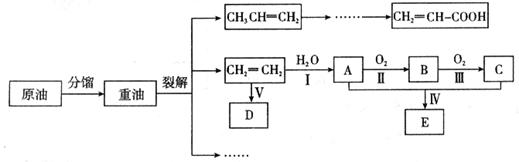
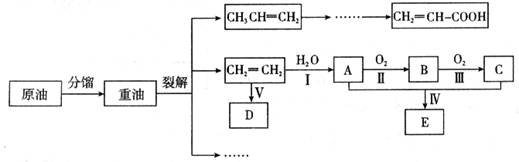
乙烯是来自石油的重要有机化工原料,其产量通常用来衡量一个国家的石油化工发展水平。结合以下路线回答:
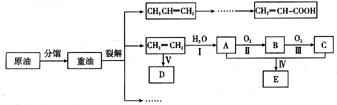
已知:![]()
(1)反应II的化学方程式是 。
(2)D为高分子化合物,可以用来制造多种包装材料,其结构简式是 。
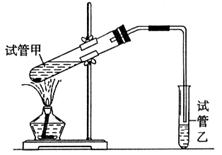
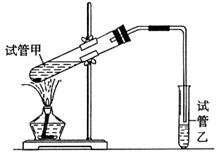
(3)E是有香味的物质,在实验室用下图装置制取。
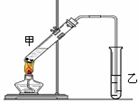
①反应IV的化学方程式是 ,该反应类型为 。
②该装置图中有一个明显的错误是 。
(4)为了证明浓硫酸在反应IV中起到了催化剂和吸水剂的作用,某同学利用上图改进后装置进行了以下4个实验。实验开始先用酒精灯微热3min,再加热使之微微沸腾3min。实验结束后充分振荡小试管乙再测有机层的厚度,实验记录如下:
| 实验编号 | 试管甲中试剂 | 试管乙中试剂 | 有机层的厚度/cm |
| A | 2 mL乙醇、1 mL乙酸、 1mL18mol·L-1 浓硫酸 | 饱和Na2CO3溶液 | 3.0 |
| B | 2 mL乙醇、1 mL乙酸 | 0.1 | |
| C | 2 mL乙醇、1 mL乙酸、 3 mL 2mol·L-1 H2SO4 | 0.6 | |
| D | 2 mL乙醇、1 mL乙酸、盐酸 | 0.6 |
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是3mL和 mol·L-1 。
②分析实验 (填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率。
(1)2CH3CH2OH+O2![]() 2CH3CHO+2H2O(2分,条件也可写成
2CH3CHO+2H2O(2分,条件也可写成![]() )
)
(2)![]() (1分)
(1分)
(3)①CH3COOH+HOCH2CH3![]() CH3COOCH2CH3+H2O。(2分,“浓硫酸、加热”或“
CH3COOCH2CH3+H2O。(2分,“浓硫酸、加热”或“![]() ”缺一项共扣1分) 取代反应或酯化反应(1分)
”缺一项共扣1分) 取代反应或酯化反应(1分)
②导气管的出口伸入到饱和碳酸钠溶液液面以下(2分)
(4)① 4 (1分) ②A C(2分,错选不得分,漏选得1分)
【解析】
试题分析:乙烯含有碳碳双键,能发生加聚反应,生成聚乙烯,则D是聚乙烯。乙烯也能和水发生加成反应生成乙醇,则A是乙醇。乙醇发生氧化反应生成B,所以B是乙醛。乙醛继续被氧化生成乙酸,所以C是乙酸。乙酸和乙醇发生酯化反应生成乙酸乙酯,则E是乙酸。
(1)反应II是乙醇的催化氧化生成乙醛,反应的化学方程式是2CH3CH2OH+O2![]() 2CH3CHO+2H2O。
2CH3CHO+2H2O。
(2)D为聚乙烯,属于高分子化合物,可以用来制造多种包装材料,其结构简式是![]() 。
。
(3)①反应IV是制备乙酸乙酯的,反应的化学方程式是
CH3COOH+HOCH2CH3![]() CH3COOCH2CH3+H2O。
CH3COOCH2CH3+H2O。
②由于生成的乙酸乙酯中含有乙酸和乙醇,二者都是与水互溶的,吸收装置中如果直接插入到碳酸钠溶液中,容易引起倒吸,所以该装置图中有一个明显的错误是导气管的出口伸入到饱和碳酸钠溶液液面以下。
(4)①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用,所以在实验中氢离子的浓度应该是相同的。C中硫酸是二元强酸,所以根据硫酸的浓度可知,D中盐酸的浓度应该是4mol/L。
②根据表中数据可知,实验A和C中分别加入了浓硫酸和稀硫酸,所以通过分析实验A、C的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率。
考点:考查有机物的推断、有机反应类型、方程式的书写以及实验方案分析与评价等
点评:该题是基础性试题的考查,涉及烯、醇、酯、羧酸等性质与转化,难度不大,是对有机知识的综合运用。有机推断是高考中的常见题型,每年高考中必考,经常给出某反应信息要求学生加以应用,能较好的考查考生的阅读、自学能力和思维能力,是热点题型,需要重点掌握。该题的难点是乙酸乙酯制备的实验分析和判断以及实验方案与设计评价。