题目内容
13.已知某弱酸的酸式盐NaH2XO4和Na2HXO4,其中NaH2XO4溶液呈弱酸性,Na2HXO4呈弱碱性,在10°C时,浓度为0.1molL-的NaH2XO4和Na2HXO4溶液中均存在的关系是( )| A. | [c(H+)•c(OH-)]>1×10-14 | |
| B. | c(Na+)+c(H+)=c(H2XO4-)+c(OH-)+2c(HXO42-)+3c(XO43-) | |
| C. | c(H+)+2c(H3XO4)+c(H2XO4-)=c(XO43-)+c(OH-) | |
| D. | c(H+)+c(H3XO4)=c(HXO42-)+2c(XO43-)+c(OH-) |
分析 NaH2XO4的溶液呈酸性,说明H2XO4-电离程度大于水解程度,Na2HXO4溶液呈碱性,说明HXO42-水解程度大于电离程度,溶液中存在物料守恒,0.1mol•L-1NaH2XO4溶液中存在:c(Na+)=c(H2XO4-)+c(HXO42-)+c(XO43-)+c(H3XO4),Na2HXO4溶液中存在:c(Na+)=2c(H2XO4-)+2c(HXO42-)+2c(XO43-)+2c(H3XO4),由溶液呈电中性原则可知,c(Na+)+c(H+)=c(H2XO4-)+c(OH-)+2c(HXO42-)+3c(XO43-),结合物料守恒和电荷守恒联式比较,注意水的离子积常数与温度的关系.
解答 解:A.常温下c(H+)•c(OH-)=1×10-14,温度升高,促进水的电离,水的离子积常数增大,则10℃时,c(H+)•c(OH-)<1×10-14,故A错误;
B.由溶液呈电中性原则可知,溶液中阳离子所带电荷等于阴离子所带电荷,则c(Na+)+c(H+)=c(H2XO4-)+c(OH-)+2c(HXO42-)+3c(XO43-),故B正确;
C.溶液中存在物料守恒,0.1mol•L-1NaH2XO4溶液中存在:c(Na+)=c(H2XO4-)+c(HXO42-)+c(XO43-)+c(H3XO4),
Na2HXO4溶液中存在:c(Na+)=2c(H2XO4-)+2c(HXO42-)+2c(XO43-)+2c(H3XO4),
由电中性原则可知,两种溶液中都存在:c(Na+)+c(H+)=c(H2XO4-)+c(OH-)+2c(HXO42-)+3c(XO43-),
则有0.1mol•L-1NaH2XO4溶液中存在:c(H3XO4)+c(H+)=c(OH-)+c(HXO42-)+2c(XO43-),
Na2HXO4溶液中存在:c(H2XO4-)+c(H+)+2c(H3XO4)=c(OH-)+c(XO43-),则只有Na2HXO4溶液中存在该关系,故C错误;
D.由C分析可知,只有0.1mol•L-1NaH2XO4溶液中存在该关系,故D错误.
故选B.
点评 本题考查离子浓度的大小比较,题目难度较大,解答本题时注意从守恒的角度分析,本题中还要注意题目要求,即浓度均为0.1mol•L-1NaH2XO4溶液和Na2HXO4溶液中均存在的关系,此为解答该题的关键之处,注意审题.

| A. | 苯与硝酸在加热时发生取代反应,甲苯与硝酸在常温下就能发生取代反应 | |
| B. | 乙醇、苯酚都有羟基,但是电离常数不同 | |
| C. | 苯酚无需催化剂即能与溴水发生取代反应 | |
| D. | 1 mol甲苯能与3 mol H2发生加成反应 |
| A. | ${\;}_{19}^{40}$K与${\;}_{20}^{40}$Ca | B. | 3H2O与1H2O | ||
| C. | ${\;}_{19}^{40}$K与${\;}_{19}^{39}$K | D. | 金刚石与石墨 |
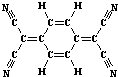
| A. | 分子中所有的氮原子在同一平面内 | B. | 属于芳香烃 | ||
| C. | 分子式为C12H4N4 | D. | 该物质难溶于水 |
| A. | 稀硫酸加入氢氧化钡溶液中:H++OH-=H2O | |
| B. | 铜片上滴加稀硝酸:3Cu+8H++2 NO3-═3Cu2++2NO↑+4H2O | |
| C. | 石灰石投入到稀盐酸中:CO32-+2 H+=CO2↑+H2O | |
| D. | Fe 粉加入稀盐酸中:2 Fe+6 H+=2 Fe3++3 H2↑ |
①煤、石油、天燃气是当今世界最重要的化石能源
②电力、风力、生物质能均是可能再生的一次能源
③吸热反应发生时可能不要加热,放热反应发生时也可能需要加热
④等质量的糖类在体内发生氧化还原反应和在体外燃烧均生成CO2和液态水时,放出的能量不可能相等
⑤充电电池可以无限制地反复放电、充电.
| A. | ①③⑤ | B. | ①②③⑤ | C. | ①③ | D. | ①③④⑤ |
| A. | 1.6gCH4中含有的电子数 | |
| B. | 100mL1mol/LH2SO4中含有H+的数 | |
| C. | 24gMg与足量稀盐酸反应转移的电子数 | |
| D. | 标准状况下,22.4LCO气体中含有的原子数 |
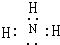 ,实验室制取该氢化物的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
,实验室制取该氢化物的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O. .
. .
.