题目内容
某化学兴趣小组在探究次氯酸钠溶液的性质时发现:往过量FeSO4溶液中滴入几滴NaClO溶液,并加入适量硫酸,溶液立即变黄.请你协助他们完成该反应还原产物的探究.
(1)甲同学推测该反应的还原产物为Cl2;乙同学推测该反应的还原产物为
(2)你认为甲同学的推测是否正确?
根据乙同学的推测,上述反应的离子方程式为
(3)请你设计一个实验方案,验证乙同学的推测(还原产物)是否正确.要求在答题卡上按下表格式写出实验步骤、预期现象和结论:
(1)甲同学推测该反应的还原产物为Cl2;乙同学推测该反应的还原产物为
Cl-
Cl-
.(2)你认为甲同学的推测是否正确?
不正确
不正确
(填“正确”或“不正确”).请用简要的文字或离子方程式说明理由因为FeSO4过量,反应中有剩余,而Cl2与Fe2+不能共存,2Fe2++Cl2=2Cl-+2Fe3+,因此还原产物不可能为Cl2
因为FeSO4过量,反应中有剩余,而Cl2与Fe2+不能共存,2Fe2++Cl2=2Cl-+2Fe3+,因此还原产物不可能为Cl2
.根据乙同学的推测,上述反应的离子方程式为
2Fe2++ClO-+2H+=2Fe3++Cl-+H2O
2Fe2++ClO-+2H+=2Fe3++Cl-+H2O
.(3)请你设计一个实验方案,验证乙同学的推测(还原产物)是否正确.要求在答题卡上按下表格式写出实验步骤、预期现象和结论:
| 实验操作 | 预期现象和结论 |
| 步骤1: | |
| 步骤2: |
分析:(1)根据氯元素由+1价降低为0价或者是-1价来回答;
(2)氯气具有氧化性,能将亚铁离子氧化为三价铁离子;
(3)可以验证溶液中是否含有硫酸根离子以及氯离子来证明乙同学的推测(还原产物)是否正确.
(2)氯气具有氧化性,能将亚铁离子氧化为三价铁离子;
(3)可以验证溶液中是否含有硫酸根离子以及氯离子来证明乙同学的推测(还原产物)是否正确.
解答:解:(1)往过量FeSO4溶液中滴入几滴NaClO溶液,并加入适量硫酸,亚铁离子具有还原性,次氯酸跟具有氧化性,氯元素的化合价有降低的趋势,降为0价产生氯气或者是降为-1价,产生氯离子,故答案为:Cl-;
(2)该反应的还原产物不可能为Cl2,因为FeSO4过量,在反应中有剩余,而Cl2与Fe2+不能共存,2Fe2++Cl2=2Cl-+2Fe3+,因此还原产物不可能为Cl2,亚铁离子和次氯酸跟在酸性环境下的反应为:2Fe2++ClO-+2H+=2Fe3++Cl-+H2O,
故答案为:因为FeSO4过量,反应中有剩余,而Cl2与Fe2+不能共存,2Fe2++Cl2=2Cl-+2Fe3+,因此还原产物不可能为Cl2;2Fe2++ClO-+2H+=2Fe3++Cl-+H2O;
(3)可以证明溶液中含有过量的硫酸亚铁来确定产物中不含有氯气,可以用硝酸钡来检验硫酸根的存在,此外,可以用硝酸酸化的硝酸银来证明氯离子的产生,故答案为:
.
(2)该反应的还原产物不可能为Cl2,因为FeSO4过量,在反应中有剩余,而Cl2与Fe2+不能共存,2Fe2++Cl2=2Cl-+2Fe3+,因此还原产物不可能为Cl2,亚铁离子和次氯酸跟在酸性环境下的反应为:2Fe2++ClO-+2H+=2Fe3++Cl-+H2O,
故答案为:因为FeSO4过量,反应中有剩余,而Cl2与Fe2+不能共存,2Fe2++Cl2=2Cl-+2Fe3+,因此还原产物不可能为Cl2;2Fe2++ClO-+2H+=2Fe3++Cl-+H2O;
(3)可以证明溶液中含有过量的硫酸亚铁来确定产物中不含有氯气,可以用硝酸钡来检验硫酸根的存在,此外,可以用硝酸酸化的硝酸银来证明氯离子的产生,故答案为:
| 实验步骤 | 预期现象和结论 |
| 步骤1:取上述反应后的溶液少许于试管A中,滴加过量Ba(NO3)2溶液,静置 | 有白色沉淀生成 |
| 步骤2:取试管A中的上层清液于试管B中,滴几滴稀HNO3和几滴AgNO3溶液 | 若有白色沉淀生成,则乙同学的推测正确;若没有白色沉淀生成,则乙同学的推测不正确 |
点评:本题是一道氧化还原反应知识的综合应用知识题目,要求学生具有分析和解决问题的能力,难度较大.

练习册系列答案
相关题目
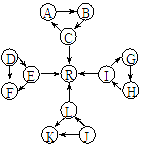 某化学兴趣小组在探究常见物质转化时,发现部分物质存在如图所示的三角转化关系(部分反应物或生成物已略去):
某化学兴趣小组在探究常见物质转化时,发现部分物质存在如图所示的三角转化关系(部分反应物或生成物已略去): 物或生成物已略去):
物或生成物已略去):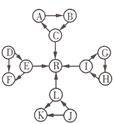
 回答下列问题:
回答下列问题: 2)写出下列反应的离子方程式:
2)写出下列反应的离子方程式: