题目内容
8.从浓度为98%,密度为1.84g•cm-3的浓硫酸试剂瓶中取出10mL的浓硫酸,然后稀释至1L,则所得稀硫酸的物质的量浓度为( )| A. | 1.84 mol•L-1 | B. | 18.4 mol•L-1 | C. | 0.184 mol•L-1 | D. | 0.018 4 mol•L-1 |
分析 先计算出10mL浓硫酸中含有硫酸的物质的量,稀释过程中溶质的物质的量不变,最后根据c=$\frac{n}{V}$计算出稀释后所得溶液的浓度.
解答 解:10mL 浓度为98%,密度为1.84g•cm-3的浓硫酸中含有硫酸的物质的量为:$\frac{1.84×10×98%}{98}$mol=0.184mol,
将取出的10mL溶液稀释至1L过程中硫酸的物质的量不变,则稀释后所得溶液的浓度为:$\frac{0.184mol}{1L}$=0.184mol/L,
故选C.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确稀释过程中溶质的物质的量不变为解答关键,注意掌握物质的量浓度的概念及表达式,试题培养了学生的化学计算能力.

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
9.下列离子方程式不正确的是( )
| A. | 用Cu作阳极电解饱和食盐水:Cu+2H+$\frac{\underline{\;电解\;}}{\;}$Cu2++H2↑ | |
| B. | Fe3O4溶于氢碘酸溶液中:Fe3O4+8H++2I-=3Fe2++I2+4H2O | |
| C. | NH4Al(SO4)2溶于过量的浓Ba(OH)2溶液中:NH4++A13++2SO42-+2Ba2++5OH-=2BaSO4↓+AlO2-+NH3↑+H2O | |
| D. | 澄清石灰水中充入过量的SO2:SO2+OH-=HSO3- |
10.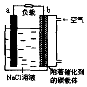 如图是镁一空气燃料电池工作原理示惫图,电池总反应为:2Mg+O2+2H2O=2Mg(OH)2.下列有关该电池的说法正确的是( )
如图是镁一空气燃料电池工作原理示惫图,电池总反应为:2Mg+O2+2H2O=2Mg(OH)2.下列有关该电池的说法正确的是( )
 如图是镁一空气燃料电池工作原理示惫图,电池总反应为:2Mg+O2+2H2O=2Mg(OH)2.下列有关该电池的说法正确的是( )
如图是镁一空气燃料电池工作原理示惫图,电池总反应为:2Mg+O2+2H2O=2Mg(OH)2.下列有关该电池的说法正确的是( )| A. | a极为负极,发生还原反应 | |
| B. | b电极上电极反应:O2+2H2O+4e-=4OH- | |
| C. | 工作时电子由b极经外电路流向a极 | |
| D. | 该装置实现了电能转化成化学能 |
7.设NA表示阿伏德罗常数的值,下列叙述正确的是( )
| A. | 2.8g铁粉与50mL 4mol•L-1盐酸反应,转移电子的数目为0.15NA | |
| B. | 常温常压下,NA个CO2分子占有的体积为22.4L | |
| C. | 常温常压下,16g O2和O3混合气体中含有的氧原子数为NA | |
| D. | 1mol•L-1 AlCl3溶液中含有的Cl-数目为3NA |
3.某酸性FeSO3溶液中含有少量的SnSO4,为得到纯净的硫酸亚铁晶体(FeSO4•xH2O),可向溶液中通入H2S气体至饱和,然后用硫酸酸化至pH=2,过滤后,将所得滤液蒸发浓缩、冷却结晶、过滤洗涤,得到硫酸亚铁晶体.查阅资料,得到相关物质的有关数据如表:
(1)用硫酸亚铁晶体配置FeSO4溶液时还需加入的物质是铁粉和稀硫酸;
(2)为检验制得的硫酸亚铁晶体中是否含有Fe3+,可选用的试剂为AC;
A.KSCN溶液B.稀硫酸C.淀粉-KI溶液D.KMnO4溶液
(3)通入H2S气体至饱和的目的是除去溶液中的Sn2+离子,并防止Fe2+被氧化;用硫酸酸化至pH=2的目的是防止Fe2+离子生成沉淀;
(4)为研究硫酸亚铁晶体的热分解,某兴趣小组同学称取ag硫酸亚铁晶体样品,按图1装置进行高温加热,使其完全分解(硫酸亚铁晶体在高温条件下回分解为三种化合物和一种单质,该单质能使带火星的木条复燃),对所得产物进行探究,并通过称量装置B的质量测出x的值.
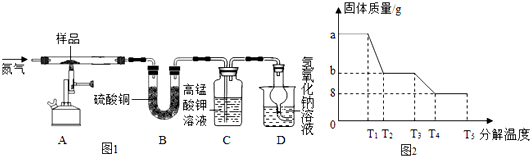
①装置B中午睡硫酸铜粉末变蓝,质量增加12.6g,说明产物中有水,装置C中高锰酸钾溶液褪色,说明产物中含有二氧化硫;
②实验中要持续通入氮气,否则测出的x会偏小(填“偏大”、“偏小”或“不变”);
③硫酸亚铁晶体完全分解后装置A中固体呈红棕色,将其加入足量稀盐酸中,固体全部溶解,得黄色溶液;
④某研究所利用SDTQ600热分析仪对硫酸亚铁晶体进行热分解,获得相关数据,绘制成的固体质量与分解温度的关系图如图2,根据图中有关数据,可计算出x为7.
| 25℃ | pH | 25℃ | pH |
| 饱和H2S溶液 | 3.9 | FeS开始沉淀 | 3.0 |
| SnS沉淀完全 | 1.6 | FeS沉淀完全 | 5.5 |
(2)为检验制得的硫酸亚铁晶体中是否含有Fe3+,可选用的试剂为AC;
A.KSCN溶液B.稀硫酸C.淀粉-KI溶液D.KMnO4溶液
(3)通入H2S气体至饱和的目的是除去溶液中的Sn2+离子,并防止Fe2+被氧化;用硫酸酸化至pH=2的目的是防止Fe2+离子生成沉淀;
(4)为研究硫酸亚铁晶体的热分解,某兴趣小组同学称取ag硫酸亚铁晶体样品,按图1装置进行高温加热,使其完全分解(硫酸亚铁晶体在高温条件下回分解为三种化合物和一种单质,该单质能使带火星的木条复燃),对所得产物进行探究,并通过称量装置B的质量测出x的值.

①装置B中午睡硫酸铜粉末变蓝,质量增加12.6g,说明产物中有水,装置C中高锰酸钾溶液褪色,说明产物中含有二氧化硫;
②实验中要持续通入氮气,否则测出的x会偏小(填“偏大”、“偏小”或“不变”);
③硫酸亚铁晶体完全分解后装置A中固体呈红棕色,将其加入足量稀盐酸中,固体全部溶解,得黄色溶液;
④某研究所利用SDTQ600热分析仪对硫酸亚铁晶体进行热分解,获得相关数据,绘制成的固体质量与分解温度的关系图如图2,根据图中有关数据,可计算出x为7.
20.下列溶液暴露于空气中,开始一段时间其pH变小的是(不考虑溶质挥发)( )
①H2S ②H2SO3③Na2S ④Ca(OH)2 ⑤氯水 ⑥Na2SO3.
①H2S ②H2SO3③Na2S ④Ca(OH)2 ⑤氯水 ⑥Na2SO3.
| A. | ①③④ | B. | ②⑤⑥ | C. | ①②④⑤ | D. | ②④⑤⑥ |
17.据报道,科学家已成功合成了少量的O4,有关O4的说法正确的是( )
| A. | O4的摩尔质量是64g | |
| B. | O4与O3、O2互为同位素 | |
| C. | 相同质量的O4与O3所含原子个数之比为1:1 | |
| D. | 32gO4所含的电子数为32NA(NA为阿伏加德罗常数) |
18.TiO2既是制备其他含钛化合物的原料,又是一种性能优异的白色颜料.
(1)实验室利用反应TiO2(s)+2CCl4(g)═TiCl4(g)+CO2(g),在无水无氧条件下,制取TiCl4实验装置示意图如下:

有关性质如表:
仪器A的名称是干燥管,装置E中的试剂是浓硫酸.反应开始前依次进行如下操作:①停止通氮气②熄灭酒精灯③冷却至室温.正确的顺序为②③①(填序号).欲分离D中的液态混合物,所采用操作的名称是蒸馏.
(2)工业上由钛铁矿(FeTiO3)(含Fe2O3、SiO2等杂质)制备TiO2的有关反应包括:
酸溶FeTiO3(s)+2H2SO4(aq)═FeSO4(aq)+TiOSO4(aq)+2H2O(l)
水解TiOSO4(aq)+2H2O(l)═H2TiO3(s)+H2SO4(aq)
简要工艺流程如下:
①试剂A为铁粉.钛液Ⅰ需冷却至70℃左右,若温度过高会导致产品收率降低,原因是由于TiOSO4容易水解,若温度过高,则会有较多TiOSO4水解为固体H2TiO3而经过滤进入FeSO4•7H2O中导致TiO2产率降低.
②取少量酸洗后的H2TiO3,加入盐酸并振荡,滴加KSCN溶液后无明显现象,再加H2O2后出现微红色,说明H2TiO3中存在的杂质离子是Fe2+.这种H2TiO3即使用水充分洗涤,煅烧后获得的TiO2也会发黄,发黄的杂质是Fe2O3(填化学式).
(1)实验室利用反应TiO2(s)+2CCl4(g)═TiCl4(g)+CO2(g),在无水无氧条件下,制取TiCl4实验装置示意图如下:

有关性质如表:
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
(2)工业上由钛铁矿(FeTiO3)(含Fe2O3、SiO2等杂质)制备TiO2的有关反应包括:
酸溶FeTiO3(s)+2H2SO4(aq)═FeSO4(aq)+TiOSO4(aq)+2H2O(l)
水解TiOSO4(aq)+2H2O(l)═H2TiO3(s)+H2SO4(aq)
简要工艺流程如下:

①试剂A为铁粉.钛液Ⅰ需冷却至70℃左右,若温度过高会导致产品收率降低,原因是由于TiOSO4容易水解,若温度过高,则会有较多TiOSO4水解为固体H2TiO3而经过滤进入FeSO4•7H2O中导致TiO2产率降低.
②取少量酸洗后的H2TiO3,加入盐酸并振荡,滴加KSCN溶液后无明显现象,再加H2O2后出现微红色,说明H2TiO3中存在的杂质离子是Fe2+.这种H2TiO3即使用水充分洗涤,煅烧后获得的TiO2也会发黄,发黄的杂质是Fe2O3(填化学式).