题目内容
在一定条件下,将物质的量之比为1∶3的N2和H2 102g通入密闭容器中,达到平衡后,测知混合气体的平均相对分子质量为12.5。求混合气体中NH3的质量?
32.64g
设N2的物质的量为x,则H2的物质的量是3x,由题意知,28g/mol×x+2g/mol×3x=102g,解之,得:x=3mol。又由:
N2(g)+3H2(g)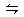 2NH3(g)
2NH3(g)
n(开始)/mol: 3 9 0
n(转化)/mol: a 3a 2a
n(平衡)/mol: 3-a 9-3a 2a
(3-a)+(9-3a)+2a=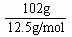 =8.16mol
=8.16mol
解之,得:a=1.92mol。
则混合气体中NH3的质量为:2×1.92mol×17g/mol=32.64
N2(g)+3H2(g)
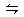 2NH3(g)
2NH3(g)n(开始)/mol: 3 9 0
n(转化)/mol: a 3a 2a
n(平衡)/mol: 3-a 9-3a 2a
(3-a)+(9-3a)+2a=
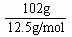 =8.16mol
=8.16mol解之,得:a=1.92mol。
则混合气体中NH3的质量为:2×1.92mol×17g/mol=32.64

练习册系列答案
 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案
相关题目
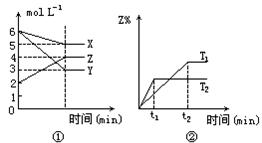
 2Z-Q
2Z-Q 2SO3(g),根据下列要求填写空白:
2SO3(g),根据下列要求填写空白: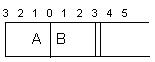
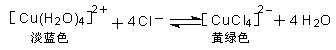
 xC(g),达到平衡后,C的体积分数为W% 。若维持容器体积和温度不变,按0.6 mol A、0.3 mol B、1.4 mol C 为起始物质,达到平衡后,C的体积分数也为W% ,则x值为( )
xC(g),达到平衡后,C的体积分数为W% 。若维持容器体积和温度不变,按0.6 mol A、0.3 mol B、1.4 mol C 为起始物质,达到平衡后,C的体积分数也为W% ,则x值为( )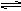 H2(g)+Br2(g);△H>0,达化学平衡时,要使混合气体的颜色加深,可采取的方法是( )
H2(g)+Br2(g);△H>0,达化学平衡时,要使混合气体的颜色加深,可采取的方法是( )  2SO2 (g) + O2 (g) 2SO3 (g);△H=-a kJ·mol-1在相同条件下,要想得到2a kJ热量,加入各物质的物质的量可以是 ( )
2SO2 (g) + O2 (g) 2SO3 (g);△H=-a kJ·mol-1在相同条件下,要想得到2a kJ热量,加入各物质的物质的量可以是 ( )