题目内容
【题目】用混有硫酸亚铁和硫酸镁等杂质的锰矿(含MnO2、MnCO3)生产硫酸锰,实验室模拟生产过程如下:
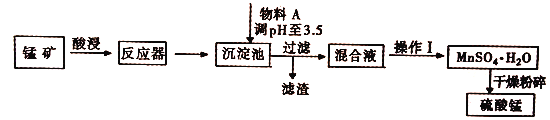
(完全沉淀离子的pH值:Fe3+为3.5,Fe2+为9.5,Mn2+为10.8,Mg2+为11.6)
(1)酸浸中加入的酸是________(填化学式,下同),提高酸浸速率的方法是____(任写一种),从经济效益考虑,物料A可能是___________。
(2)反应器中发生氧化还原反应的离子方程式是___________________ 。
(3)硫酸锰和硫酸镁的溶解度曲线如图所示:
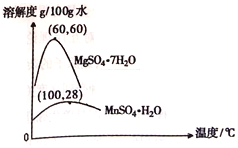
①操作I为:在_____℃下蒸发结晶、趁热过滤。其趁热过滤目的是__________;
②为了得到更纯净的一水合硫酸锰,需将晶体置于过滤器中,用_____进行洗涤(本空格从以下选择)
a.蒸馏水 b.稀硫酸 c.饱和硫酸锰溶液 d.氢氧化钠溶液
(4)MnSO4·H2O在1150℃高温下易分解,产物是Mn304、含硫化合物、水,在该条件下硫酸锰晶体分解反应的化学方程式是___________________。
【答案】 H2SO4 粉碎、搅拌等 MnCO3等 MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O 60 防止MgSO4结晶析出,提高MnSO4的产率 c 3MnSO4·H2O![]() Mn3O4+SO2↑+2SO3↑+3H2O↑
Mn3O4+SO2↑+2SO3↑+3H2O↑
【解析】(1)本流程要制备硫酸锰,因此要用硫酸酸浸;为提高酸浸的速率,加快反应速率,可以将原材料粉碎,搅拌等;所加的试剂A,可起到调节pH的作用,使铁离子水解生成沉淀,为不引入新杂质,从经济效益考虑,加入![]() 或MnO或
或MnO或![]() ;正确答案:H2SO4 ;粉碎、搅拌等 ; MnCO3等。
;正确答案:H2SO4 ;粉碎、搅拌等 ; MnCO3等。
(2) 反应器中为二氧化锰在酸性条件下氧化亚铁离子,该反应为氧化还原反应,离子方程式为:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O ;正确答案:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O。
(3)①由图可以知道60℃时,硫酸镁的溶解度最大,便于硫酸锰与硫酸镁的分离;为防止硫酸镁的结晶析出,提高硫酸锰的产率,趁热过滤;正确答案:60;防止MgSO4结晶析出,提高MnSO4的产率。
②蒸馏水、稀硫酸、氢氧化钠洗涤晶体,会损失一水合硫酸锰,饱和硫酸锰溶液能够减少产品一水合硫酸锰的损失,C正确;正确答案C。
(4)MnSO4·H2O在1150℃高温下易分解,产物是Mn304、含硫化合物、水,反应的方程式:3MnSO4·H2O![]() Mn3O4+SO2↑+2SO3↑+3H2O↑;正确答案:3MnSO4·H2O
Mn3O4+SO2↑+2SO3↑+3H2O↑;正确答案:3MnSO4·H2O![]() Mn3O4+SO2↑+2SO3↑+3H2O↑。
Mn3O4+SO2↑+2SO3↑+3H2O↑。

 阅读快车系列答案
阅读快车系列答案【题目】已知1molSiO2含有4mol Si—O。有关键能数据如表,晶体硅在氧气中燃烧的热化学方程式:Si(s)+O2(g)=SiO2(s);ΔH=-989.2kJ·mol-1,则表中x的值为
化学键 | Si—O | O=O | Si—Si |
键能/kJ·mol-1 | x | 498.8 | 176 |
A. 460 B. 920 C. 1165.2 D. 423.3
【题目】三氯氧磷(POCl3)俗名磷酰氯、氧氯化磷,是重要的基础化工原料,可用于制取染料、农药,有机合成的氯化剂、催化剂和阻燃剂等。某化学实验小组模拟PCl3直接氧化法制备POCl3,其实验装置设计如下:
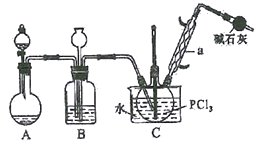
有关物质的部分性质如下表:
熔点/℃ | 沸点/℃ | 其他 | |
PCl3 | -112 | 75.5 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
POCl3 | 2 | 105.3 | 遇水生成H3PO4和HCl,能溶于PCl3 |
回答下列问题:
(1)仪器a的名称是__________,装置A中发生反应的化学方程式为__________________。
(2)B中所装试剂为__________,B装置的作用除观察O2的流速之外,还有_____________________。
(3)C装置控制反应在60℃~65℃进行,其控温的主要目的是__________。
(4)实验制得的POCl3粗产品中常含有PCl3,可用__________方法提纯。
(5)通过佛尔哈德法可以测定三氯氧磷产品中Cl元素含量,实验步骤如下:
Ⅰ.取ag产品于锥形瓶中,加入足量NaOH溶液,待完全反应后加稀硝酸至酸性。
Ⅱ.向锥形瓶中加入0.1000mol·L-1的AgNO3溶液40.00mL,使Cl-完全沉淀。
Ⅲ.向其中加入2mL硝基苯,用力摇动,使沉淀表面被有机物覆盖,以防止在滴加NH4SCN时,将AgCl沉淀转化为AgSCN沉淀。
Ⅳ.加入指示剂,用cmol·L-1NH4SCN溶液滴定过量Ag+至终点,记下所用体积VmL。
已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2×10-12
①滴定选用的指示剂是__________ (填标号)。
a.FeCl2 b.甲基橙 c.淀粉 d.NH4Fe(SO4)2
②Cl元素的质量百分含量为__________ (列出算式)。
③在步骤Ⅲ中,若无加入硝基苯的操作,所测Cl-元素含量将会__________(填“偏大”“偏小”或“不变”)。

