��Ŀ����
����Ŀ��ijѧϰС��ͬѧΪ̽��ͬ���ڻ�ͬ����Ԫ�����ʵĵݱ���ɣ����������ϵ��ʵ�飺
������ͼװ������֤ͬ����Ԫ�طǽ����Եı仯���ɣ�
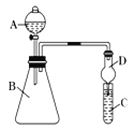
��1��Ҫ֤���ǽ����ԣ�Cl>I����A�м�Ũ���ᣬB�м�KMnO4(KMnO4��Ũ���᳣���·�Ӧ��������)��C�мӵ��۵⻯�ػ����Һ���۲쵽C����Һ________________��������֤���������D��������___________________���ӻ��������ĽǶȿ��ǣ���װ����ȱ��β������װ�ã�����___________��Һ����β����
��2��Ҫ֤���ǽ����ԣ�C>Si����A�м����ᣬB�м�CaCO3��C�м�Na2SiO3��Һ�����۲쵽C��______________��������ʦ��Ϊ������������֤������ǿ����ϵΪ̼����ᣬ����������������_______________________________��
���Ӧ��B��D֮������һ��ʢ������____(ѡ��������ĸ��A��Ũ���� B��ŨNaOH��ҺC������Na2CO3��Һ D������NaHCO3��Һ)��ϴ��װ�á�
�Ľ���C�з�����Ӧ�Ļ�ѧ����ʽ��___________________________________��
���𰸡� ���� ��ֹ��Һ���� NaOH �а�ɫ�������� ��B�лӷ�����HClҲ���������Һ��Ӧ���ɹ��� D Na2SiO3+CO2+H2O == H2SiO3��+Na2CO3����Na2SiO3+2CO2+2H2O == H2SiO3��+2NaHCO3��
��������(1)Ũ���������ط�Ӧ������������������ǿ�����ԣ�����⻯�ط�Ӧ���ɵ⣬������������ɫ����ɹ۲쵽��Һ���������θ����D�ܹ���ֹ���������Ա���C��Һ�������ƿ�У������ж��������ŷŵ������У���������������Һ��Ӧ�������գ����������������Һ����β�����գ�����ʱ��Ҳ����ʯ��ˮ���գ��ʴ�Ϊ����������ֹ��Һ������NaOH��
(2)��̼��ȹ���ǿ��������̼��������Ʒ�Ӧ���ɹ����������Һ����ǣ���B�лӷ�����HClҲ���������Һ��Ӧ���ɹ��ᣬ�Ȼ�����лӷ��ԣ�����ʵ��������Ҫ��������̼�е��Ȼ�������������Ȼ�����̼�����Ʒ�Ӧ����������̼����Ӧ��������B��D֮������װ�б���NaHCO3��Һ��ϴ��ƿ���Ľ���C�з�����Ӧ�Ļ�ѧ����ʽ��Na2SiO3+CO2+H2O�TH2SiO3��+Na2CO3(��Na2SiO3+2CO2+2H2O�TH2SiO3��+2NaHCO3���ʴ�Ϊ���а�ɫ�������ɣ���B�лӷ�����HClҲ���������Һ��Ӧ���ɹ��D��Na2SiO3+CO2+H2O�TH2SiO3��+Na2CO3(��Na2SiO3+2CO2+2H2O�TH2SiO3��+2NaHCO3��

����Ŀ����������Ƶ�����֣�����Ӱ�����ǵ�����ͽ�����������Ҫ��Ⱦ��Ϊ�����������PM2.5������Ҫ��ԴΪȼú��������β���ȡ���ˣ���PM2.5��SO2��NOx�Ƚ����о�������Ҫ���塣��ش��������⣺
��1����PM2.5����������ˮ�����Ƴɴ���������
����ø���������ˮ���������ӵĻ�ѧ��ּ���ƽ��Ũ�����±���
���� | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
Ũ��mol/L | 4��10-6 | 6��10-6 | 2��10-5 | 4��10-5 | 3��10-5 | 2��10-5 |
���ݱ��������ж�������pH=_________��
��2������β����NOx��CO�����ɣ�
����֪����������NO�ķ�ӦΪ��N2(g)+O2(g)![]() 2NO(g) ��H>0���£������ܱ������У�����˵������˵���÷�Ӧ�ﵽ��ѧƽ��״̬����____
2NO(g) ��H>0���£������ܱ������У�����˵������˵���÷�Ӧ�ﵽ��ѧƽ��״̬����____
A.���������ܶȲ��ٱ仯 B.��������ƽ�����������ٱ仯
C.N2��O2��NO�����ʵ���֮��Ϊ1��1��2 D.�����İٷֺ������ٱ仯
������ȼ�Ͳ���ȫȼ��ʱ����CO���������밴���з�Ӧ��ȥCO��2CO(g)=2C(s)+O2(g)����֪�÷�Ӧ�ġ�H��0����������ܷ�ʵ��______________����ܡ����ܡ���
��3��Ϊ����SO2���ŷţ�����ȡ�Ĵ�ʩ�У�
�ٽ�úת��Ϊ�������ȼ�ϡ���֪��
H2(g)+ 1/2O2(g) =H2O(g) ��H=��241.8kJ��mol-1
C(s)+1/2O2(g) =CO(g)��H =-110.5kJ��mol-1
д����̿��ˮ������Ӧ���Ȼ�ѧ����ʽ��___________________��
��ϴ�Ӻ�SO2��������
��4������β����������Ҫԭ����2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)����H��0�����÷�Ӧ�ھ��ȡ����ݵ��ܱ���ϵ�н��У�����ʾ��ͼ��ȷ����˵����Ӧ�ڽ��е�t1ʱ�̴ﵽƽ��״̬����_________������ţ�������ͼ��v����K��n��w�ֱ��ʾ����Ӧ���ʡ�ƽ�ⳣ�������ʵ���������������
2CO2(g)+N2(g)����H��0�����÷�Ӧ�ھ��ȡ����ݵ��ܱ���ϵ�н��У�����ʾ��ͼ��ȷ����˵����Ӧ�ڽ��е�t1ʱ�̴ﵽƽ��״̬����_________������ţ�������ͼ��v����K��n��w�ֱ��ʾ����Ӧ���ʡ�ƽ�ⳣ�������ʵ���������������

�����ŷŵĵ������úȼ�ղ����Ķ��������ǵ������������ġ�������ס�֮һ������̿�ɴ���������Ⱦ��NO����5L�ܱ������м���NO�ͻ���̿�����������ʣ���һ����������������E��F�����¶ȷֱ���T1���T2��ʱ����ø�����ƽ��ʱ���ʵ�����n/mol�����±���
���� �¶�/�� | ����̿ | NO | E | F |
��ʼ | 3.000 | 0.10 | 0 | 0 |
T1 | 2.960 | 0.020 | 0.040 | 0.040 |
T2 | 2.975 | 0.050 | 0.025 | 0.025 |
��1��д��NO�����̿��Ӧ�Ļ�ѧ����ʽ______________________��
��2������������ӦT1��ʱ��ƽ�ⳣ��K1=__________________����T1��T2����÷�Ӧ�ġ�H__________________0(���������������������
��3��������ӦT1��ʱ�ﵽ��ѧƽ�����ͨ��0.1molNO���壬��ﵽ�»�ѧƽ��ʱNO��ת����Ϊ________��

