题目内容
【化学一物质结构与性质】A-E是周期表中1一36号的元素,它们的原子序数依次递增且分别位于前四周期的各个 周期中.对它们的性质及结构的描述如下.
A原子的基态只有一种形状的电子云,并容易形成共价键;B原子的最外电子层的电子排 布可表示为nsnnpn,其元素最高正化合价与最低负化合价的代数和为0;C与B同周期,其 第一电离能髙于周期表中与之相邻的所有元素;D元素在周期表中位于C元素的下一周 期,其电负性在同周期元素中最大;E原子最外电子层只有未成对电子,其内层所有轨道全 部充满,但并不是第IA族元素.
(1)请写出E原子基态的电子排布式 .
(2)A与C形成的最简单化合物(甲)分子的立体结构是 ,其中C原子的杂化方式是 .
(3)A与D元素形成的化合物(乙)与甲相比,沸点较低的是(写化学式) 原因是 .
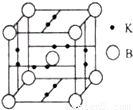
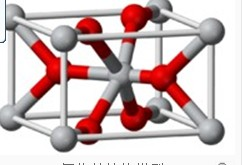
(4)B元素可形成B70单质,它在一定条件下吸收可见光后可高效 杀灭癌细胞,有望成为癌症治疗药物的候选材料.它与金属钾掺杂在一起的化合物,其晶胞如图所示(白球位于立方体的体心和顶 点,小黑球位于立方体的面上),则该化合物中B70与钾原子个数比为 .
【答案】分析:A原子的基态只有一种形状的电子云,并容易形成共价键,则A是H元素;
B原子的最外电子层的电子排布可表示为nsnnpn,则n=2,其元素最高正化合价与最低负化合价的代数和为0,所以B是C元素;
C与B同周期,其第一电离能髙于周期表中与之相邻的所有元素,且C的原子序数大于B,则C是N元素;
D元素在周期表中位于C元素的下一周期,其电负性在同周期元素中最大,所以D是Cl元素;
E原子最外电子层只有未成对电子,其内层所有轨道全部充满,但并不是第IA族元素,则E是Cu元素.
解答:解:A原子的基态只有一种形状的电子云,并容易形成共价键,则A是H元素;
B原子的最外电子层的电子排布可表示为nsnnpn,则n=2,其元素最高正化合价与最低负化合价的代数和为0,所以B是C元素;
C与B同周期,其第一电离能髙于周期表中与之相邻的所有元素,且C的原子序数大于B,则C是N元素;
D元素在周期表中位于C元素的下一周期,其电负性在同周期元素中最大,所以D是Cl元素;
E原子最外电子层只有未成对电子,其内层所有轨道全部充满,但并不是第IA族元素,则E是Cu元素.
(1)E是29号元素,其原子核外有29个电子,根据构造原理知,其原子基态的电子排布式为[Ar]3d104s1,
故答案为:[Ar]3d104s1;
(2)A与C形成的最简单化合物是NH3,氨气分子中N原子含有的价层电子对=3+1=4,且含有一个孤电子对,所以其空间构型是三角锥型,采取sp3杂化,故答案为:三角锥型,sp3;
(3)A与D元素形成的化合物是HCl,与甲相比,沸点较低的是HCl,氨气分子间存在氢键,氯化氢分子间不存在氢键,氢键的存在导致其沸点增大,故答案为:HCl,氨气分子之间存在氢键,氯化氢分子间不存在氢键;
(4)该晶胞中K原子个数=2×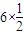 =6,B原子个数=1+
=6,B原子个数=1+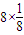 =2,所以该化合物中B70与钾原子个数比=2:6=1:3,故答案为:1:3.
=2,所以该化合物中B70与钾原子个数比=2:6=1:3,故答案为:1:3.
点评:考查核外电子排布规律、杂化轨道、分子空间结构、氢键与化学键、晶胞等,综合性较大,难度中等,是对知识的综合运用,需要学生具备扎实的基础与分析问题解决问题的能力.
B原子的最外电子层的电子排布可表示为nsnnpn,则n=2,其元素最高正化合价与最低负化合价的代数和为0,所以B是C元素;
C与B同周期,其第一电离能髙于周期表中与之相邻的所有元素,且C的原子序数大于B,则C是N元素;
D元素在周期表中位于C元素的下一周期,其电负性在同周期元素中最大,所以D是Cl元素;
E原子最外电子层只有未成对电子,其内层所有轨道全部充满,但并不是第IA族元素,则E是Cu元素.
解答:解:A原子的基态只有一种形状的电子云,并容易形成共价键,则A是H元素;
B原子的最外电子层的电子排布可表示为nsnnpn,则n=2,其元素最高正化合价与最低负化合价的代数和为0,所以B是C元素;
C与B同周期,其第一电离能髙于周期表中与之相邻的所有元素,且C的原子序数大于B,则C是N元素;
D元素在周期表中位于C元素的下一周期,其电负性在同周期元素中最大,所以D是Cl元素;
E原子最外电子层只有未成对电子,其内层所有轨道全部充满,但并不是第IA族元素,则E是Cu元素.
(1)E是29号元素,其原子核外有29个电子,根据构造原理知,其原子基态的电子排布式为[Ar]3d104s1,
故答案为:[Ar]3d104s1;
(2)A与C形成的最简单化合物是NH3,氨气分子中N原子含有的价层电子对=3+1=4,且含有一个孤电子对,所以其空间构型是三角锥型,采取sp3杂化,故答案为:三角锥型,sp3;
(3)A与D元素形成的化合物是HCl,与甲相比,沸点较低的是HCl,氨气分子间存在氢键,氯化氢分子间不存在氢键,氢键的存在导致其沸点增大,故答案为:HCl,氨气分子之间存在氢键,氯化氢分子间不存在氢键;
(4)该晶胞中K原子个数=2×
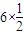 =6,B原子个数=1+
=6,B原子个数=1+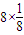 =2,所以该化合物中B70与钾原子个数比=2:6=1:3,故答案为:1:3.
=2,所以该化合物中B70与钾原子个数比=2:6=1:3,故答案为:1:3.点评:考查核外电子排布规律、杂化轨道、分子空间结构、氢键与化学键、晶胞等,综合性较大,难度中等,是对知识的综合运用,需要学生具备扎实的基础与分析问题解决问题的能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
(13分)【化学一物质结构与性质】
A、B、M、X、Y、Z是元素周期表中的前 20号元素.且原子序数依次增大。已知它们的部分化台物的性质如下表所示
20号元素.且原子序数依次增大。已知它们的部分化台物的性质如下表所示
| A的最简单氢化物 | B的最简单氢化物 | M的最简单氢化物 | X的氧化物 | Y的最简单氢化物 | Z的最高价氧化物 |
| 含氢量最高的有机物 | 水溶液呈碱性 | 水溶液呈酸性 | 两性氧化物 | 分子呈正四面体构型 | 对应水化物为最强酸 |
(1)写出X原子的电子排布式 。
(2)A、B、M电负性由大到小的排列顺序为 。
(3)Y的最简单氢化物中,Y原子的杂化形式是 。
(4)B的最简单氢化物分子的空间构型是 ,属于 分子(填“极性”或“非极性”)。
(5)比较熔点高低:A最高价氧化物的熔点 Y最高价氧化物的熔点。
(6)判断沸点高低:M氢化物的沸点 Z氢化物的沸点,原因是 。
(13分)【化学一物质结构与性质】
A、B、M、X、Y、Z是元素周期表中的前20号元素.且原子序数依次增大。已知它们的部分化台物的性质如下表所示
|
A的最简单氢化物 |
B的最简单氢化物 |
M的最简单氢化物 |
X的氧化物 |
Y的最简单氢化物 |
Z的最高价氧化物 |
|
含氢量最高的有机物 |
水溶液呈碱性 |
水溶液呈酸性 |
两性氧化物 |
分子呈正四面体构型 |
对应水化物为最强酸 |
回答下列问题
(1)写出X原子的电子排布式 。
(2)A、B、M电负性由大到小的排列顺序为 。
(3)Y的最简单氢化物中,Y原子的杂化形式是 。
(4)B的最简单氢化物分子的空间构型是 ,属于 分子(填“极性”或“非极性”)。
(5)比较熔点高低:A最高价氧化物的熔点 Y最高价氧化物的熔点。
(6)判断沸点高低:M氢化物的沸点 Z氢化物的沸点,原因是 。

 (2013?德州一模)【化学一物质结构与性质】
(2013?德州一模)【化学一物质结构与性质】