题目内容
【题目】在4 L密闭容器中充入6 mol A气体和5 mol B气体,在一定条件下发生反应:3A(g)+B(g)![]() 2C(g)+xD(g),达到平衡时,生成了2 mol C,经测定,D的浓度为0.5 mol·L-1,下列判断正确的是( )。
2C(g)+xD(g),达到平衡时,生成了2 mol C,经测定,D的浓度为0.5 mol·L-1,下列判断正确的是( )。
A. x=1
B. 达到平衡时,在相同温度下容器内混合气体的压强是反应前的85%
C. 平衡时A的浓度为1.50 mol·L-1
D. B的转化率为20%
【答案】D
【解析】
达到平衡时,生成了2mol C,经测定,D的浓度为0.5molL-1,生成D为0.5mol/L×4L=2mol,生成C、D的物质的量相同,化学方程式的化学计量数之比等于参与反应的物质的物质的量之比,利用三段式,再结合![]() 、转化率=
、转化率=![]() ×100%,在相同条件下压强比等于物质的量比计算,据此分析作答。
×100%,在相同条件下压强比等于物质的量比计算,据此分析作答。
0.5mol/L×4L = 2 mol,生成C与D的物质的量相同,结合反应可知x=2,则
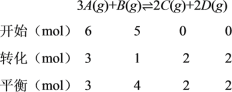 ,
,
A. 由上述分析可知,x=2,A项错误;
B. 达到平衡时,在相同温度下容器内混合气体的压强是反应前的![]() =1,即压强不变,B项错误;
=1,即压强不变,B项错误;
C. 平衡时A的浓度为![]() =0.75 molL1,C项错误;
=0.75 molL1,C项错误;
D. B的转化率为![]() ×100% = 20%,D项正确;
×100% = 20%,D项正确;
答案选D。

练习册系列答案
相关题目