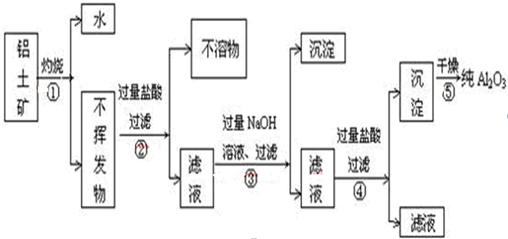
题目内容
从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的通常有两种工艺.因向铝土矿中加入NaOH时形成的赤泥(残渣)中常含有铝硅酸钠,故流程乙常处理SiO2含量小于8%的铝土矿,若SiO2含量较高则可采用流程甲来处理.

请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的离子方程式为
(2)流程乙加入烧碱后生成SiO32-的离子方程式为
(3)流程甲滤液D中通入过量CO2的化学方程式为
(4)“通入过量CO2”能否改用盐酸
(5)滤液E、K中溶质的主要成分是

请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的离子方程式为
Al2O3+6H+=2Al3++3H2O
Al2O3+6H+=2Al3++3H2O
.(2)流程乙加入烧碱后生成SiO32-的离子方程式为
SiO2+2OH-=SiO32-+H2O
SiO2+2OH-=SiO32-+H2O
.(3)流程甲滤液D中通入过量CO2的化学方程式为
NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
.(4)“通入过量CO2”能否改用盐酸
不能
不能
,原因是Al(OH)3沉淀会溶于过量的盐酸中
Al(OH)3沉淀会溶于过量的盐酸中
.(5)滤液E、K中溶质的主要成分是
NaHCO3
NaHCO3
(填化学式),写出该溶质的一种用途制纯碱或做发酵粉等
制纯碱或做发酵粉等
.分析:(1)氧化铝和盐酸反应生成氯化铝和水;
(2)SiO2和氢氧化钠反应生成硅酸钠盐和水;
(3)偏铝酸钠中通过量的二氧化碳可以生成氢氧化铝白色沉淀和碳酸氢钠溶液,能据此制取氢氧化铝;
(4)偏铝酸钠和过量的盐酸反应生成氯化铝、氯化钠和水;
(5)偏铝酸钠中通过量的二氧化碳可以生成氢氧化铝白色沉淀和碳酸氢钠溶液,根据小苏打的用途来回答.
(2)SiO2和氢氧化钠反应生成硅酸钠盐和水;
(3)偏铝酸钠中通过量的二氧化碳可以生成氢氧化铝白色沉淀和碳酸氢钠溶液,能据此制取氢氧化铝;
(4)偏铝酸钠和过量的盐酸反应生成氯化铝、氯化钠和水;
(5)偏铝酸钠中通过量的二氧化碳可以生成氢氧化铝白色沉淀和碳酸氢钠溶液,根据小苏打的用途来回答.
解答:解:(1)流程甲加入盐酸后,铝土矿中的Al2O3、Fe2O3、MgO能和盐酸反应,氧化铝和盐酸反应生成氯化铝和水,生成Al3+的离子方程式为Al2O3+6H+=2Al3++3H2O,故答案为:Al2O3+6H+=2Al3++3H2O;
(2)流程乙加入氢氧化钠后,铝土矿中的Al2O3、SiO2能和氢氧化钠反应,SiO2和氢氧化钠反应生成硅酸钠盐和水,离子方程式为:SiO2+2OH-=SiO32-+H2O,故答案为:SiO2+2OH-=SiO32-+H2O;
(3)流程甲加入盐酸后,铝土矿中的Al2O3、Fe2O3、MgO能和盐酸反应,所得的滤液B有氯化铝、氯化铁、氯化镁以及过量的盐酸,向其中加过量的烧碱,所得滤液D的主要成分为偏铝酸钠,通入过量CO2的化学方程式为NaA1O2+CO2+H2O=A1(OH)3↓+NaHCO3,故答案为:NaA1O2+CO2+2H2O=A1(OH)3↓+NaHCO3;
(4)偏铝酸钠和过量的盐酸反应生成氯化铝、氯化钠和水,不会获得氢氧化铝,故答案为:不能;A1(OH)3沉淀会溶于过量的盐酸中;
(5)滤液Y和D的成分主要是偏铝酸钠,向其中通入过量CO2的化学方程式为NaA1O2+CO2+H2O=A1(OH)3↓+NaHCO3,NaHCO3是滤液E、K中溶质的主要成分,可以制纯碱或做发酵粉等,故答案为:NaHCO3;制纯碱或做发酵粉等.
(2)流程乙加入氢氧化钠后,铝土矿中的Al2O3、SiO2能和氢氧化钠反应,SiO2和氢氧化钠反应生成硅酸钠盐和水,离子方程式为:SiO2+2OH-=SiO32-+H2O,故答案为:SiO2+2OH-=SiO32-+H2O;
(3)流程甲加入盐酸后,铝土矿中的Al2O3、Fe2O3、MgO能和盐酸反应,所得的滤液B有氯化铝、氯化铁、氯化镁以及过量的盐酸,向其中加过量的烧碱,所得滤液D的主要成分为偏铝酸钠,通入过量CO2的化学方程式为NaA1O2+CO2+H2O=A1(OH)3↓+NaHCO3,故答案为:NaA1O2+CO2+2H2O=A1(OH)3↓+NaHCO3;
(4)偏铝酸钠和过量的盐酸反应生成氯化铝、氯化钠和水,不会获得氢氧化铝,故答案为:不能;A1(OH)3沉淀会溶于过量的盐酸中;
(5)滤液Y和D的成分主要是偏铝酸钠,向其中通入过量CO2的化学方程式为NaA1O2+CO2+H2O=A1(OH)3↓+NaHCO3,NaHCO3是滤液E、K中溶质的主要成分,可以制纯碱或做发酵粉等,故答案为:NaHCO3;制纯碱或做发酵粉等.
点评:本题考查金属铝的化合物的相关性质,是一道综合题,考察角度广,难度较大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目