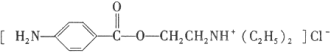题目内容
【题目】如图是一套制取并验证氯气部分化学性质的实验装置.

回答下列问题:反应的方程式:MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
(1)装置A中,仪器a的名称叫 ,该仪器中盛有的试剂为 .
(2)当Cl2气流通过一段时间后,装置B中溶液的pH值 7(填“>”“<”或“=”),写出Cl2与水反应的方程式
(3)当有少量Cl2气流通过后,观察到装置C中的溶液变为 色,反应的离子方程式为 .
(4)当Cl2气流持续通过时,装置D中干燥的有色布条能否褪色?为什么? .
(5)装置E的作用是 .
【答案】(1)分液漏斗,浓盐酸(2)<,Cl2+H2O═HCl+HClO(3)蓝色;Cl2+2I﹣=2Cl﹣+I2(4)能,因为干燥的氯气没有漂白性(5)吸收多余的氯气
【解析】解:(1)分析装置图和仪器,装置A是氯气的发生装置,利用分液漏斗将浓盐酸滴入烧瓶中加热反应;故答案为:分液漏斗,浓盐酸;
(2)氯气既溶解于水又和水反应生成盐酸和次氯酸,反应化学方程式为:Cl2+H2O═HCl+HClO,溶液呈酸性,溶液PH小于7;
故答案为:<,Cl2+H2O═HCl+HClO;
(3)装置C中通过氯气会发生氧化还原反应,氯气氧化碘离子为碘单质,反应离子方程式为:Cl2+2I﹣=2Cl﹣+I2,碘单质遇到淀粉变蓝;
故答案为:蓝色;Cl2+2I﹣=2Cl﹣+I2;
(4)湿润的氯气遇到干燥的有色布条能褪色,起漂白作用的是次氯酸,能使干燥的有色布条褪色;故答案为:能,因为干燥的氯气没有漂白性;
(5)氯气是污染性气体,不能排放到空气中,需要用氢氧化钠溶液吸收;
故答案为:吸收多余的氯气.

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案
相关题目