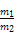题目内容
一定条件下, Ni2+与丁二酮肟生成鲜红色沉淀A。

(1)基态Ni2+的核外电子排布式为 。
(2)丁二酮肟组成元素中C、N、O的电负性由大到小的顺序为 。丁二酮肟分子中C原子轨道的杂化类型是 。
(3)元素Ni的一种碲(Te)化物晶体的晶胞结构如图所示,则该化合物的化学式为 。
(4)Ni(CO)4是一种无色液体,沸点为42.1℃,熔点为-19.3℃。Ni(CO)4的晶体类型是 。请写出一种由第二周期主族元素组成的且与CO互为等电子体的阴离子的电子式 。
(1)1s22s22p63s23p63d8(或[Ar]3d8)
(2)O>N>C sp3和sp2
(3)NiTe2
(4)分子晶体 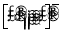 或
或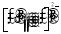
【解析】
试题分析:(1)镍是28号元素,基态Ni2+的核外电子有26个电子,排布式为1s22s22p63s23p63d8(或[Ar]3d8)。(2)C、N、O处于同一周期,由左到右电负性依次增加,电负性由大到小的顺序为O>N>C 。丁二酮肟分子中C原子形成了双键和单键,轨道的杂化类型是sp3和sp2 。(3)根据晶体中棱角上的原子有效占有数是1/8,共有1个Ni,体内的完全占有共2个Te,则该化合物的化学式为NiTe2。(4)Ni(CO)4是一种无色液体,沸点为42.1℃,熔点为-19.3℃。由其熔沸点都比较低,可失利Ni(CO)4的晶体类型是分子晶体。等电子体是原子总数和价电子总数都分别相等的分子。与CO互为等电子体的阴离子的电子式 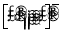 或
或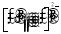 。
。
考点:本题考查物质结构中核外电子排布式的书写,电负性由大小判断,杂货类型的判断,晶体中微粒化学式的确定,类型判断及等电子体等知识。

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案观察下列模型并结合有关信息进行判断,下列说法错误的是( )
| HCN | S8 | SF6 | B12结构单元 |
结构模 型示意 图 |
|
|
|
|
备注 | / | 易溶于CS2 | / | B的熔点为1873K |
A.HCN的结构式为H—C≡N
B.固态S8属于原子晶体
C.SF6是由极性键构成的非极性分子
D.单质硼属于原子晶体,其结构单元中含有30个B—B键