题目内容
燃烧电池是燃料(如CO、H2、CH4等)跟氧气(或空气)起反应将化学能转化为电能的装置,电解质溶液是强碱(如KOH)溶液,下面关于甲烷燃烧电池的说法不正确的是
- A.正极反应式为O2+2H2O+4e—=4OH—
- B.负极反应式为CH4+10OH——8e—=CO32—+7H2O
- C.随着放电的进行,溶液的pH值不变
- D.甲烷燃烧电池的能量利用率比甲烷燃烧的大
C
原电池中负极失去电子,正极得到电子,所以选项AB正确。将正负极电极反应式叠加即得到总反应式为CH4+2O2=CO32-+3H2O,因此溶液的碱性是降低的,C不正确。D是正确的,所以答案是C。
原电池中负极失去电子,正极得到电子,所以选项AB正确。将正负极电极反应式叠加即得到总反应式为CH4+2O2=CO32-+3H2O,因此溶液的碱性是降低的,C不正确。D是正确的,所以答案是C。

练习册系列答案
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案
相关题目
 、
、 、
、 )等跟
)等跟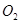 (或空气)起反应将化学能转变为电能的装置,电解质溶液是强碱(如
(或空气)起反应将化学能转变为电能的装置,电解质溶液是强碱(如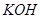 )溶液,下列关于甲烷燃料电池的说法中不正确的是:
)溶液,下列关于甲烷燃料电池的说法中不正确的是:
 )等跟O2(或空气)起反应将化学能转变为电能的装置,电解质溶液是强碱(如
)等跟O2(或空气)起反应将化学能转变为电能的装置,电解质溶液是强碱(如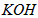 )溶液,下列关于甲烷燃料电池的说法中不正确的是
)溶液,下列关于甲烷燃料电池的说法中不正确的是