题目内容
下列叙述中正确的是( )
分析:A.根据元素的化合价变化判断;
B.根据元素周期律分析;
C.同种元素之间形成非极性共价键,不同元素之间形成极性共价键,分子中正负电荷中心不重合,从整个分子来看,电荷的分布是不均匀的,不对称的,这样的分子为极性分子,以极性键结合的双原子一定为极性分子,以极性键结合的多原子分子如结构对称,正负电荷的重心重合,电荷分布均匀,则为非极性分子;
D.分子间作用力与氢键不属于化学键,作用力较小.
B.根据元素周期律分析;
C.同种元素之间形成非极性共价键,不同元素之间形成极性共价键,分子中正负电荷中心不重合,从整个分子来看,电荷的分布是不均匀的,不对称的,这样的分子为极性分子,以极性键结合的双原子一定为极性分子,以极性键结合的多原子分子如结构对称,正负电荷的重心重合,电荷分布均匀,则为非极性分子;
D.分子间作用力与氢键不属于化学键,作用力较小.
解答:解:A.某非金属元素从游离态变成化合态时,该元素可能被氧化,也可能被还原,故A错误;
B.同一主族元素氢化物的稳定性随着原子序数的增大而减小,所以气态氢化物的稳定性:HF>HCl,故B正确;
C.NF3分子的结构是三角锥形,结构不对称,正负电荷的重心不重合,电荷分布不均匀,为极性分子,故C错误;
D.分子间作用力与氢键不属于化学键,作用力较小.只影响物理性质,如熔沸点,密度等,而化学键物理性质和化学性质均可影响,故D错误.
故选B.
B.同一主族元素氢化物的稳定性随着原子序数的增大而减小,所以气态氢化物的稳定性:HF>HCl,故B正确;
C.NF3分子的结构是三角锥形,结构不对称,正负电荷的重心不重合,电荷分布不均匀,为极性分子,故C错误;
D.分子间作用力与氢键不属于化学键,作用力较小.只影响物理性质,如熔沸点,密度等,而化学键物理性质和化学性质均可影响,故D错误.
故选B.
点评:本题考查了极性键、极性分子、元素周期律等知识点,难度不大,平时注意知识的积累.

练习册系列答案
 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案
相关题目
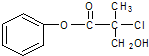 有机物A是农药生产中的一种中间体,结构简式如图所示.下列叙述中正确的是( )
有机物A是农药生产中的一种中间体,结构简式如图所示.下列叙述中正确的是( )| A、有机物A可以在一定条件下与HBr发生反应 | B、1mol A最多能与4mol H2发生加成反应 | C、有机物A与浓硫酸混合加热,可以发生消去反应 | D、1mol A与足量的NaOH溶液反应,最多可以消耗3mol NaOH |


