题目内容
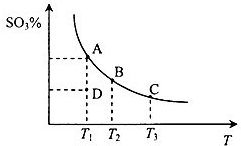 (2013?烟台一模)二氧化硫的催化氧化原理为2SO2(g)+O2(g)?2SO3(g),反应混合体系在平衡状态时SO3的百分含量与温度的关系如图所示.下列说法错误的是( )
(2013?烟台一模)二氧化硫的催化氧化原理为2SO2(g)+O2(g)?2SO3(g),反应混合体系在平衡状态时SO3的百分含量与温度的关系如图所示.下列说法错误的是( )分析:A、曲线上的点都是平衡点,D点SO3的百分含量低于相同温度平衡点的含量,说明D点未到达平衡状态,反应向正反应移动;
B、曲线上的点都是平衡点,由图可知,温度越高,SO3的百分含量越低,说明升高温度平衡向逆反应移动;
C、升高温度,平衡向逆反应移动,故温度越高平衡常数越小;
D、恒温恒压下向平衡体系中通入氦气,体积增大,压强降低,平衡向体积增大的方向移动.
B、曲线上的点都是平衡点,由图可知,温度越高,SO3的百分含量越低,说明升高温度平衡向逆反应移动;
C、升高温度,平衡向逆反应移动,故温度越高平衡常数越小;
D、恒温恒压下向平衡体系中通入氦气,体积增大,压强降低,平衡向体积增大的方向移动.
解答:解:A、曲线上的点都是平衡点,D点SO3的百分含量低于相同温度平衡点的含量,说明D点未到达平衡状态,反应向正反应移动,故v 正>v逆,故A错误;
B、曲线上的点都是平衡点,由图可知,温度越高,SO3的百分含量越低,说明升高温度平衡向逆反应移动,故该反应正反应是放热反应,故B正确;
C、升高温度,平衡向逆反应移动,故温度越高平衡常数越小,B点的温度低于C的温度,故平衡常数,KB>KC,故C正确;
D、恒温恒压下向平衡体系中通入氦气,体积增大,压强降低,平衡向体积增大的方向移动,即向平衡向左移动,故D正确.
故选A.
B、曲线上的点都是平衡点,由图可知,温度越高,SO3的百分含量越低,说明升高温度平衡向逆反应移动,故该反应正反应是放热反应,故B正确;
C、升高温度,平衡向逆反应移动,故温度越高平衡常数越小,B点的温度低于C的温度,故平衡常数,KB>KC,故C正确;
D、恒温恒压下向平衡体系中通入氦气,体积增大,压强降低,平衡向体积增大的方向移动,即向平衡向左移动,故D正确.
故选A.
点评:本题考查化学平衡图象、化学平衡移动的影响因素等,难度中等,注意根据SO3的含量判断平衡移动的方向.

练习册系列答案
相关题目