题目内容
11.下列说法正确的是( )| A. | 硫酸的摩尔质量是98 g | B. | 1mol O2的质量是32g | ||
| C. | 2g氢气所含原子数目为1 mol | D. | 22.4LCH4物质的量是1mol |
分析 A.摩尔质量的单位是g/mol;
B.根据m=nM计算氧气质量;
C.2g氢气的物质的量是1mol,根据N=nNA结合分子构成计算原子个数;
D.气体摩尔体积受温度和压强影响.
解答 解:A.摩尔质量的单位是g/mol,是数值上分子的相对分子质量与其摩尔质量相等,所以硫酸的摩尔质量是98g/mol,故A错误;
B.氧气质量m=nM=1mol×32g/mol=32g,故B正确;
C.2g氢气的物质的量是1mol,氢气分子数N=nNA=1mol×NA/mol=NA,每个分子含有两个原子,所以原子总数为2NA,故C错误;
D.气体摩尔体积受温度和压强影响,温度和压强未知导致气体摩尔体积未知,所以无法计算甲烷物质的量,故D错误;
故选B.
点评 本题考查物质的量有关计算,为高频考点,明确物质的量有关公式是解本题关键,易错选项是D,注意气体摩尔体积适用范围及适用条件,为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.对于反应A(g)+3B(g)?2C(g),下列各数据表示不同条件下的反应速率,其中反应进行得最快的是( )
| A. | v(A)═0.01 mol/(L•s) | B. | v (B)═0.02 mol/(L•s) | ||
| C. | v (B)═0.60mol/(L•min) | D. | v (C)═1.0mol/(L•min) |
2.设NA为阿伏加德罗常数,下列说法中,正确的是( )
| A. | 2.4g金属镁所含电子数目为0.2NA | B. | 16gCH4所含原子数目为NA | ||
| C. | 17gNH3所含电子数目为10NA | D. | 18g水所含分子数目为NA |
19.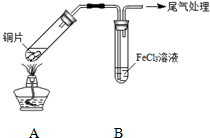 某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示.
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示.
(1)该小组同学预测SO2与FeCl3溶液反应的现象为溶液由棕黄色变成浅绿色,然后开始实验.
FeCl3溶液显酸性的原因是Fe3++3H2O?Fe(OH)3+3H+.写出装置A中产生SO2的化学方程式:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)当SO2通入到FeCl3溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象.将混合液放置12小时,溶液才变成浅绿色.
【查阅资料】Fe(HSO3)2+离子为红棕色,它可以将Fe3+还原为Fe2+.生成Fe(HSO3)2+离子的反应为可逆反应.
解释SO2与FeCl3溶液反应生成红棕色Fe(HSO3)2+离子的原因:H2O+SO2?H2SO3,H2SO3?H++HSO3-,Fe3++HSO3-?Fe(HSO3)2+.
写出溶液中Fe(HSO3)2+离子与Fe3+反应的离子方程式:Fe3++H2O+Fe(HSO3)2+═2Fe2++SO42-+3H+.
(3)为了探究如何缩短红棕色变为浅绿色的时间,该小组同学进行了步骤③的实验.
用铁氰化钾溶液检验步骤②和步骤③所得溶液中的Fe2+,其现象为生成蓝色沉淀.
(4)综合上述实验探究过程,可以获得的实验结论:
Ⅰ.SO2与FeCl3溶液反应生成红棕色中间产物Fe(HSO3)2+离子;
Ⅱ.红棕色中间产物转变成浅绿色溶液是一个较慢的过程;
Ⅲ.加热、提高FeCl3溶液的酸性会缩短浅绿色出现的时间.
 某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示.
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示.(1)该小组同学预测SO2与FeCl3溶液反应的现象为溶液由棕黄色变成浅绿色,然后开始实验.
| 步骤① | 配制1mol•L-1 FeCl3溶液(未用盐酸酸化),测其pH约为1,取少量装入试管B中,加热A. |
(2)当SO2通入到FeCl3溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象.将混合液放置12小时,溶液才变成浅绿色.
【查阅资料】Fe(HSO3)2+离子为红棕色,它可以将Fe3+还原为Fe2+.生成Fe(HSO3)2+离子的反应为可逆反应.
解释SO2与FeCl3溶液反应生成红棕色Fe(HSO3)2+离子的原因:H2O+SO2?H2SO3,H2SO3?H++HSO3-,Fe3++HSO3-?Fe(HSO3)2+.
写出溶液中Fe(HSO3)2+离子与Fe3+反应的离子方程式:Fe3++H2O+Fe(HSO3)2+═2Fe2++SO42-+3H+.
(3)为了探究如何缩短红棕色变为浅绿色的时间,该小组同学进行了步骤③的实验.
| 步骤② | 往5mL 1mol•L-1 FeCl3溶液中通入SO2气体,溶液立即变为红棕色.微热3min,溶液颜色变为浅绿色. |
| 步骤③ | 往5mL重新配制的1mol•L-1 FeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色.几分钟后,发现溶液颜色变成浅绿色. |
(4)综合上述实验探究过程,可以获得的实验结论:
Ⅰ.SO2与FeCl3溶液反应生成红棕色中间产物Fe(HSO3)2+离子;
Ⅱ.红棕色中间产物转变成浅绿色溶液是一个较慢的过程;
Ⅲ.加热、提高FeCl3溶液的酸性会缩短浅绿色出现的时间.
6.用NA表示阿伏德罗常数,下列叙述正确的是( )
| A. | 标准状况下,22.4LH2O含有的分子数为1 NA个 | |
| B. | 1mol/L 的MgCl2溶液中,含有Cl-个数为2NA个 | |
| C. | 室温时,1 NA个CO2分子占有的体积为22.4L | |
| D. | 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02NA个 |
16.在盐类的水解过程中,下列叙述不正确的是( )
| A. | 所有的盐溶液均呈中性 | |
| B. | 盐类的水解过程破坏了纯水的电离平衡 | |
| C. | 盐类的水解是酸碱中和反应的逆反应 | |
| D. | 升高温度可以促进盐类的水解 |
20.配合物在许多方面有着广泛的应用.下列叙述不正确的是( )
| A. | 以Mg2+为中心的大环配合物叶绿素能催化光合作用 | |
| B. | Fe2+的卟啉配合物是输送O2的血红素 | |
| C. | 三价铁离子和硫氰酸根离子形成的配离子常用于人造血液 | |
| D. | 钴离子的卟啉配合物是人体需要的一种维生素 |
1.下列反应的离子方程式书写正确的是( )
| A. | 过量的铁与浓硝酸反应:Fe+6H++3NO3-═Fe3++3NO2↑+3H2O | |
| B. | 次氯酸钙溶液中通入过量CO2:ClO-+CO2+H2O═HClO+HCO3- | |
| C. | 在碳酸氢镁溶液中加入足量 Ca(OH)2 溶液:Mg2++2HCO3-+Ca2++2OH-═MgCO3↓+CaCO3↓+2H2O | |
| D. | 1mol•L-1 的 NaAlO2 溶液和2.5mol•L-1 的盐酸等体积混合:2AlO2-+5 H+═Al(OH)3↓+Al3++H2 O |