题目内容
反应2A(g)+B(g)(1)A、B的转化率。
(2)平衡时混合气体的平均相对分子质量〔设A的相对分子质量为Mr(A),B的相对分子质量为Mr(B)〕(3)平衡时压强与起始时相比,有何变化?
解析:设起始时A为5 mol,则B为2 mol,达平衡时反应的A的物质的量为x。
2A + B ![]() 3C
3C
起始: 5 mol 2 mol 0
转化: x ![]() x
x ![]() x
x
平衡: (5 mol-x) 2 mol-![]()
![]() x
x
则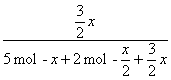 =0.6,
=0.6,
x=2.8 mol。
所以,平衡时,A的转化率为56%,B的转化率为70%。
(2)反应前后气体的物质的量不变,所以![]() =
=![]() 。
。
答案:(1)α(A)=56%,α(B)=70%
(2) ![]() =
=![]()
(3)反应前后压强不变

练习册系列答案
相关题目
在一密闭容器中通入A、B两种气体,在一定条件下反应2A(g)+B(g)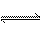 2C(g);ΔH<0。当反应达到平衡后,改变一个条件(x),下列量(y)一定符合图中曲线的是( )
2C(g);ΔH<0。当反应达到平衡后,改变一个条件(x),下列量(y)一定符合图中曲线的是( )
| x | Y |
A. | 再通入A | B的转化率 |
B. | 压强 | A的百分含量 |
C. | 温度 | 混合气体的平均相对分子质量 |
D. | 加入催化剂 | A的质量分数 |
下列说法不正确的是( )
| A.MnO2能加速H2O2的分解,是因为MnO2可以降低反应所需的活化能 |
| B.向橙色的K2Cr2O7溶液中滴加NaOH溶液,溶液颜色变黄,说明化学平衡发生了移动 |
| C.将NO2和N2O4混合气体的平衡体系加压,容器内气体颜色变深,这一事实不能用勒夏特列原理解释 |
D.在密闭容器中,对于反应2A(g)+B(g) 2C(g),增大压强后,平衡混合气的平均相对分子质量减小 2C(g),增大压强后,平衡混合气的平均相对分子质量减小 |
 2C(g)达到平衡时,A、B和C的物质的量分别为6mol、3mol和6mol。保持温度和压强不变,对平衡混合物中三者的物质的量作如下调整,可使平衡右移的是
2C(g)达到平衡时,A、B和C的物质的量分别为6mol、3mol和6mol。保持温度和压强不变,对平衡混合物中三者的物质的量作如下调整,可使平衡右移的是