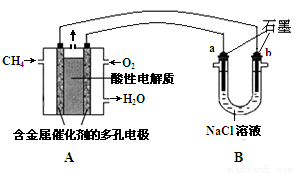
题目内容
B.碳酸钠为强碱弱酸盐水解呈碱性;
C.根据电极材料的活泼性判断正负极,根据电极上发生反应的类型判断电极反应式;
D.根据二氧化碳的化学性质进行分析,氢氧化钙能与二氧化碳反应生成碳酸钙和水.
B.碳酸钠为强碱弱酸盐,碳酸钠溶液中碳酸钠电离出的碳酸根离子水解,CO32-+H2O?HCO-3+OH-显碱性,故B正确;
C.钢铁中含有碳、铁,根据原电池工作原理,活泼的金属作负极,不如负极活泼的金属或导电的非金属作正极,所以碳作正极,铁作负极被氧化,负极Fe-2e-=Fe2+,故C错误;
D.石灰水中的溶质是氢氧化钙,能与空气中的二氧化碳反应生成碳酸钙和水;由于碳酸钙是一种不溶于水的白色物质,故瓶中常形成一种不溶于水的白色固体;反应的化学方程式为CO2+Ca(OH)2=CaCO3↓+H2O,故D正确;
故选C.

 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案分析下表中的四个热化学方程式,判断氢气和丙烷的燃烧热分别是
|
“嫦娥一号” 发射火箭燃料 |
液氢(H2) |
①2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ·mol-1 ②2H2(l)+O2(l)=2H2O(g) △H=-482.6kJ·mol-1 |
|
北京奥运会“祥云” 火炬燃料 |
丙烷(C3H8) |
③C3H8(l)+5O2(g)=3CO2(g)+4H2O(g)△H=-2013.8kJ·mol-1 ④C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=-2221.5kJ·mol-1 |
A.571.6 kJ·mol-1,2221.5kJ·mol-1 B.241.3 kJ·mol-1,2013.8 kJ·mol-1
C.285.8 kJ·mol-1,2013.8 kJ·mol-1 D.285.8 kJ·mol-1,2221.5 kJ·mol-1
分析下表中的四个热化学方程式,判断氢气和丙烷的燃烧热分别是( )
|
“嫦娥一号”发射火箭燃料 |
液氢 (H2) |
①2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ·mol-1 ②2H2(l)+O2(l)=2H2O(g) △H=-482.6kJ·mol-1 |
|
北京奥运会“祥云”火炬燃料 |
丙烷 (C3H8) |
③C3H8(l)+5O2(g)=3CO2(g)+4H2O(g)△H=-2013.8kJ·mol-1 ④ C3H8(g)+5O2(g) =3CO2(g)+4H2O(l)△H=-2221.5kJ·mol-1 |
A、571.6 kJ·mol-1,2221.5kJ·mol-1 B、241.3 kJ·mol-1,2013.8 kJ·mol-1
C、285.8 kJ·mol-1,2013.8 kJ·mol-1 D、285.8 kJ·mol-1,2221.5 kJ·mol-1



 2CO2(g)+ N2(g)。△H<0
2CO2(g)+ N2(g)。△H<0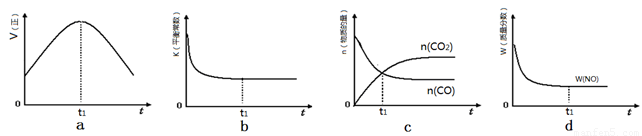
 N2O4(g)
△H=-56.9 kJ/mol
N2O4(g)
△H=-56.9 kJ/mol