题目内容
|
按照下面的反应式,在水溶液中N2H5+将Fe2+还原成Fe2+:N2H5++4Fe3+ | |
| [ ] | |
A. |
NH4+ |
B. |
N2 |
C. |
N2O |
D. |
NO2 |
解析:
根据氧化还原反应,4 mol Fe3+得到4 mol e-,则1 mol N2H5+失去4 mol e-,N2H5+中N元素的化合价为-2价,每个氮原子失2个e-,则N2H5+的氧化产物中氮原子的化合价为:-2-(-2)=0价.故选B项.

 名校课堂系列答案
名校课堂系列答案(8分)
某学生利用下面实验装置探究盐桥式原电池的工作原理(Cu元素的相对原子质量为64)。
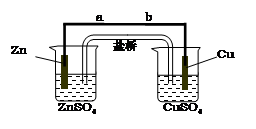
|
|
(1)写出装置中锌电极上的电极反应式: ;
(2)若装置中铜电极的质量增加0.64g,则导线中转移的电子数目为 ;
(用“NA”表示)
(3)装置中盐桥中除添加琼脂外,还要添加KCl的饱和溶液,电池工作时,对盐桥中的
K+、Cl-的移动方向表述正确的是 。
A. 盐桥中的K+向左侧烧杯移动、Cl-向右侧烧杯移动
B. 盐桥中的K+向右侧烧杯移动、Cl-向左侧烧杯移动
C. 盐桥中的K+、Cl-都向右侧烧杯移动
D. 盐桥中的K+、Cl-几乎都不移动
(4) 若ZnSO4溶液中含有杂质Cu2+,会加速Zn电极的腐蚀、还可能导致电流在较短时间内衰减。欲除去Cu2+,最好选用下列试剂中的 (填代号)。
A.NaOH B. Zn C.Fe D. H2SO4
(8分)
某学生利用下面实验装置探究盐桥式原电池的工作原理(Cu元素的相对原子质量为64)。
|
|
(1)写出装置中锌电极上的电极反应式: ;
(2) 若装置中铜电极的质量增加0.64g,则导线中转移的电子数目为 ;
(用“NA”表示)
(3) 装置中盐桥中除添加琼脂外,还要添加KCl的饱和溶液,电池工作时,对盐桥中的
K+、Cl-的移动方向表述正确的是 。
A. 盐桥中的K+向左侧烧杯移动、Cl-向右侧烧杯移动
B. 盐桥中的K+向右侧烧杯移动、Cl-向左侧烧杯移动
C. 盐桥中的K+、Cl-都向右侧烧杯移动
D. 盐桥中的K+、Cl-几乎都不移动
(4) 若ZnSO4溶液中含有杂质Cu2+,会加速Zn电极的腐蚀、还可能导致电流在较短时间内衰减。欲除去Cu2+,最好选用下列试剂中的 (填代号)。
A. NaOH B. Zn C. Fe D. H2SO4

 (R、R′可以是烃基或H原子)
(R、R′可以是烃基或H原子)


