题目内容
【题目】下列物质中,一定是纯净物的是
A.裂解气B.C2H6OC.C3H8D.聚乙烯
【答案】C
【解析】
A.石油的裂解气是多种气态烃的混合物,故A错误;
B.C2H6O可能是CH3CH2OH或CH3OCH3,则表示的可能是混合物,故B错误;
C.C3H8只能是CH3CH2CH3,一定是纯净物,故C正确;
D.聚乙烯是混合物,故D错误;
故答案为C。

【题目】CO2既是温室气体,也是重要的化工原料,二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向。
(1)用活性炭还原法可以处理汽车尾气中的氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+ 2NO(g) ![]() N2(g)+CO2(g) △H,在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
N2(g)+CO2(g) △H,在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
浓度/(mol/L)/\时间/min | 0 | 10 | 20 | 30 | 40 |
NO | 2.0 | 1.16 | 0.40 | 0.40 | 0.6 |
N2 | 0 | 0.42 | 0.80 | 0.80 | 1.2 |
CO2 | 0 | 0.42 | 0.80 | 0.80 | 1.2 |
①若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为2:3:3,则达到新平衡时NO的转化率____(填“升高”或“降低”),△H____0(填“>”或“<”)。
②根据图表数据分析T1℃时,该反应在0~10min内的平均反应速率v(N2)=__mol·L-1·min-1;计算该反应的平衡常数K=___。
③若30min后只改变某一条件,据上表中的数据判断改变的条件可能是____________(填字母编号)。
A.加入合适的催化剂 B.适当缩小容器的体积
C.通入一定量的NO D.加入一定量的活性炭
(2)工业上用CO2和H2反应合成二甲醚(CH3OCH3)。二甲醚燃料电池具有能量转化率高、电量大的特点而被广泛应用,一种二甲醚氧气电池(电解质为KOH溶液)的负极反应式为:______________。
(3)常温下,用NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3。若某次捕捉后得到pH=10 的溶液,则溶液c(CO32-)∶c(HCO3-)=____________。[常温下K1(H2CO3)=4.4×10-7、 K2(H2CO3)=5×10-11]。
【题目】“雾霾”成为人们越来越关心的环境问题.雾霾中含有二氧化硫、氮氧化物和可吸入颗粒物等污染性物质.请回答下列问题:
(1)某研究小组用NaOH溶液吸收尾气中的二氧化硫,将得到的Na2SO3溶液进行电解,其中阴阳膜组合电解装置如图所示,电极材料为石墨.
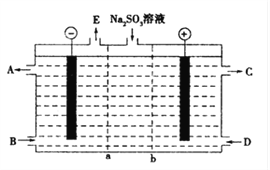
①a表示____离子交换膜(填“阴”或“阳”).A﹣E分别代表生产中的原料或产品.其中C为硫酸,则A表示______.E表示_______.
②阳极的电极反应式为___________________________________.
(2)Na2SO3溶液吸收SO2的过程中,pH随n(SO32﹣):n(HSO3﹣)变化关系如下表:
n(SO3﹣):n(HSO3﹣) | 99:1 | 1:1 | 1:99 |
pH | 8.2 | 7.2 | 6.2 |
①Na2SO3溶液显______性,理由(请用离子方程式表示)_______________________
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母): ____
a.c(Na+)=2c(SO32-)+c(HSO3-),
b.c(Na+)> c(HSO3-)> c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)= c(SO32-)+ c(HSO3-)+c(OH-)
(3)SO2经过净化后与空气混合进行催化氧化可制取硫酸,其中SO2发生催化氧化的反应为:2SO2(g)+O2(g)![]() 2SO3(g).若在T1℃、0.1MPa条件下,往一密闭容器通入SO2和O2(其中n(SO2):n(O2)=2:1),测得容器内总压强与反应时间如图所示.
2SO3(g).若在T1℃、0.1MPa条件下,往一密闭容器通入SO2和O2(其中n(SO2):n(O2)=2:1),测得容器内总压强与反应时间如图所示.
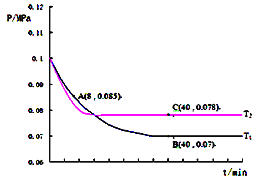
①图中A点时,SO2的转化率为________.
②在其他条件不变的情况下,测得T2℃时压强的变化曲线如图所示,C点的正反应速率vc(正)与A点的逆反应速率vA (逆)的大小关系为vc(正)_____vA (逆)(填“>”、“<”或“=”)
③图中B点的压强平衡常数kp=__________(用平衡分压代替平衡浓度计算.分压=总压×物质的量分数).