��Ŀ����
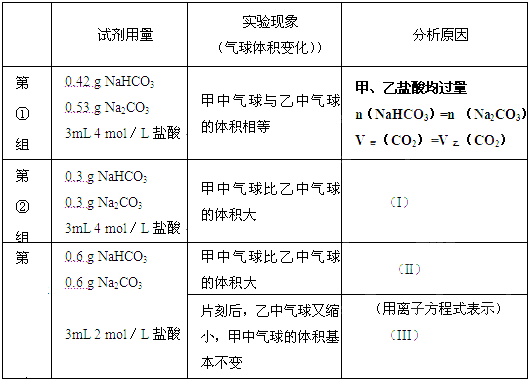
 ij�λ�ѧ��ȤС���ϣ�����ѧ���ֱ���ͼʾ�ס�����װ�ã�̽����NaHCO3��Na2CO3��ϡ����ķ�Ӧ���������е��Լ�����������ͬ�����£������������еĹ����ĩͬʱ�����Թ��У�װ�õ��������Ѽ�飩 ��ش�
ij�λ�ѧ��ȤС���ϣ�����ѧ���ֱ���ͼʾ�ס�����װ�ã�̽����NaHCO3��Na2CO3��ϡ����ķ�Ӧ���������е��Լ�����������ͬ�����£������������еĹ����ĩͬʱ�����Թ��У�װ�õ��������Ѽ�飩 ��ش���1�����鷴Ӧ��ʼʱ��
��
��
װ���е���������ȱ��װ���з�Ӧ�����ӷ���ʽ��HCO3-+H+�TH2O+CO2��
HCO3-+H+�TH2O+CO2��
����2�����Թ��в�������������ʱ������ʵ����ֲ�ͬ��������յڢ��飬����ԭ��ķ�ʽ��д�±��Ŀո�

��������1���������ɶ�����̼�ķ�Ӧ�����жϣ�
��2�����������Ӧ�����ݹ��������ж�CO2����������������������ԭ��
��I�����ж����Ƿ�������ټ���̼���ơ�̼�����Ƶ����ʵ����Ĺ�ϵ���Ӷ�ȷ����������Ĺ�ϵ��
��II�����ж����Ƿ�������ټ���̼���ơ�̼�����Ƶ����ʵ����Ĺ�ϵ���Ӷ�ȷ����������Ĺ�ϵ��
��III��������Һ�ijɷּ�������̼�����ʷ�����
��2�����������Ӧ�����ݹ��������ж�CO2����������������������ԭ��
��I�����ж����Ƿ�������ټ���̼���ơ�̼�����Ƶ����ʵ����Ĺ�ϵ���Ӷ�ȷ����������Ĺ�ϵ��
��II�����ж����Ƿ�������ټ���̼���ơ�̼�����Ƶ����ʵ����Ĺ�ϵ���Ӷ�ȷ����������Ĺ�ϵ��
��III��������Һ�ijɷּ�������̼�����ʷ�����
����⣺��1����װ�÷�����Ӧ��HCO3-+H+�TH2O+CO2������װ�÷�����Ӧ��CO32-+H+�THCO3-��HCO3-+H+�TH2O+CO2������װ���ڷ�Ӧ���ʽϿ죬��λʱ�������CO2�࣬�ʼ�װ���е���������ȱ��
�ʴ�Ϊ���ף�HCO3-+H+�TH2O+CO2����
��2����I��������ͬ��̼�����ƺ�̼���ƣ�̼�����Ƶ����ʵ�������̼���Ƶ����ʵ�����һ��̼���ƺ�̼�����Ʒ����к��е�̼ԭ�Ӹ�����ͬ����������������ᷴӦ��̼���������ɵĶ�����̼�࣮
�ʴ�Ϊ���ס��������������n��NaHCO3����n��Na2CO3����V��CO2������V��CO2������
��II����������ʵ���=6��10-3mol��n��NaHCO3��=
=7.1��10-3mol��
n��Na2CO3��=
=5.7��10-3mol��ͨ����1������ʽ֪�������������������ͬ���ʵ��������ᷴӦ�����ĵ�n��NaHCO3����n ��Na2CO3�������ɵ� V��CO2������V��CO2������
�ʴ�Ϊ���ס�������������������ĵ�n��NaHCO3����n ��Na2CO3�� V��CO2������V��CO2������
��III���÷�Ӧ��ʣ���̼���ƣ����ɵĶ�����̼�ֺ�̼���Ʒ�Ӧ����̼�����ƣ���������������٣������������С����Ӧ�����ӷ���ʽΪCO2+H2O+CO32-=2 HCO3-��
�ʴ�Ϊ��CO2+H2O+CO32-=2 HCO3-��
�ʴ�Ϊ���ף�HCO3-+H+�TH2O+CO2����
��2����I��������ͬ��̼�����ƺ�̼���ƣ�̼�����Ƶ����ʵ�������̼���Ƶ����ʵ�����һ��̼���ƺ�̼�����Ʒ����к��е�̼ԭ�Ӹ�����ͬ����������������ᷴӦ��̼���������ɵĶ�����̼�࣮
�ʴ�Ϊ���ס��������������n��NaHCO3����n��Na2CO3����V��CO2������V��CO2������
��II����������ʵ���=6��10-3mol��n��NaHCO3��=
| 0.6g |
| 84g/mol |
n��Na2CO3��=
| 0.6g |
| 106g/mol |
�ʴ�Ϊ���ס�������������������ĵ�n��NaHCO3����n ��Na2CO3�� V��CO2������V��CO2������
��III���÷�Ӧ��ʣ���̼���ƣ����ɵĶ�����̼�ֺ�̼���Ʒ�Ӧ����̼�����ƣ���������������٣������������С����Ӧ�����ӷ���ʽΪCO2+H2O+CO32-=2 HCO3-��
�ʴ�Ϊ��CO2+H2O+CO32-=2 HCO3-��
���������⿼����̼���ƺ�̼�����Ƶ����ʣ�̼���ƺ��ᷴӦ�Ƿֲ����еģ�������̼�����ƣ���̼�����ƺ��ᷴӦ���ɶ�����̼��

��ϰ��ϵ�д�
�����Ŀ
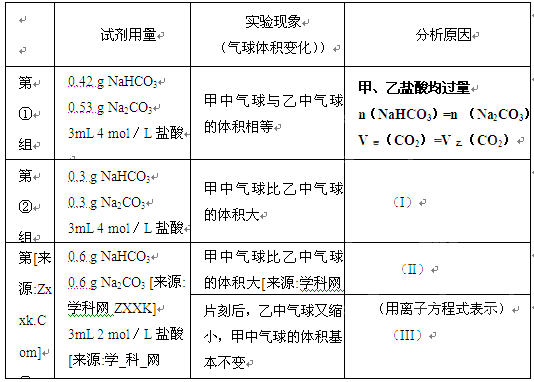

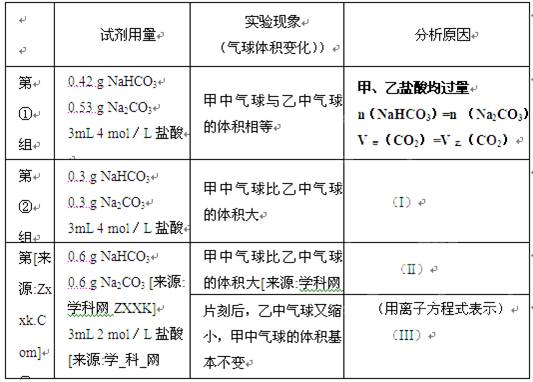
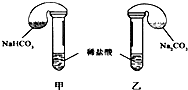 ij�λ�ѧ��ȤС���ϣ�����ѧ���ֱ���ͼʾ�ס�����װ�ã�̽����NaHCO3��Na2CO3��ϡ����ķ�Ӧ���������е��Լ�����������ͬ�����£������������еĹ����ĩͬʱ�����Թ��У�װ�õ��������Ѽ�飩 ��ش�
ij�λ�ѧ��ȤС���ϣ�����ѧ���ֱ���ͼʾ�ס�����װ�ã�̽����NaHCO3��Na2CO3��ϡ����ķ�Ӧ���������е��Լ�����������ͬ�����£������������еĹ����ĩͬʱ�����Թ��У�װ�õ��������Ѽ�飩 ��ش�