题目内容
下列叙述中正确的是 ( )
A.同主族金属元素的原子半径越大熔点越高
B.稀有气体原子序数越大沸点越低
C.分子间作用力越弱的分子其沸点越低
D.同周期元素的原子半径越小越易失去电子
【答案】
C
【解析】
试题分析:同主族金属元素的原子半径越大熔点越低,A不正确;稀有气体原子序数越大,分子间作用力越强,沸点越高,B不正确;同周期自左向右原子半径逐渐减小,非金属性逐渐增强,所以同周期元素的原子半径越小越易得到电子,D不正确,答案选C。
考点:考查晶体熔沸点的判断、元素周期律的应用
点评:本题是基础性试题的考查,试题难易适中。考查的知识点多,易于巩固学生的基础知识,有利于培养学生的解题能力。

练习册系列答案
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案
相关题目
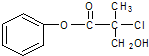 有机物A是农药生产中的一种中间体,结构简式如图所示.下列叙述中正确的是( )
有机物A是农药生产中的一种中间体,结构简式如图所示.下列叙述中正确的是( )| A、有机物A可以在一定条件下与HBr发生反应 | B、1mol A最多能与4mol H2发生加成反应 | C、有机物A与浓硫酸混合加热,可以发生消去反应 | D、1mol A与足量的NaOH溶液反应,最多可以消耗3mol NaOH |


