题目内容
实验室用浓硫酸与铜反应制取SO2气体,下列有关说法正确的是(气体体积在标准状况下测定)( )A.若提供0.2 mol H2SO4,Cu不足量,则可制得SO2气体2.24 L
B.若提供0.2 mol H2SO4,Cu过量,则可制得SO2气体2.24 L
C.若有0.2 mol H2SO4参与反应,则可制得SO2气体2.24 L
D.若有0.2 mol H2SO4被还原,则可制得SO2气体2.24 L
C
解析:本题以氧化还原反应为核心命题点,考查了Cu只能与浓硫酸反应、浓硫酸的作用等知识点及根据化学反应计算的能力。Cu只能与浓硫酸反应,随着反应的进行,浓度减小到一定程度时,反应停止。只能以参加反应的硫酸的量进行计算。参加反应的硫酸中有1/2作为氧化剂,还有1/2体现酸性。所以根据反应计算结果C项正确。

练习册系列答案
相关题目
下列关于实验原理或操作的叙述,正确的是( )
| A、实验室欲用480mL0.2mol?L-1H2SO4溶液,可用500mL容量瓶配制 | B、用图所示装置测定NaOH溶液的浓度 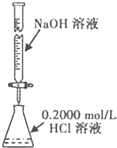 | C、铜与浓硫酸反应时,用蘸有浓溴水的棉花放在导管口吸收多余的气体 | D、制取NaCl晶体,可往烧杯中加入NaCl溶液,加热、蒸干 |