题目内容
20.常温下,下列说法不正确的是( )| A. | 0.2 mol•L-1的NaHCO3溶液中pH>7,则溶液中:c(H2CO3)>c(CO32-) | |
| B. | 叠氮酸(HN3)与醋酸酸性相近,0.1 mol•L-1NaN3水溶液中离子浓度大小顺序为:c(Na+)>c(N3-)>c(OH-)>c(H+) | |
| C. | 向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中c(NH4+)=c(Cl-) | |
| D. | 0.02 mol/L的NaOH溶液与0.02 mol/L的NaHC2O4溶液等体积混合液:2c(OH-)+c(C2O42-)=c(HC2O4-)+2c(H+) |
分析 A.0.2 mol•L-1的NaHCO3溶液中pH>7,溶液显示碱性说明HCO3-水解程度大于其电离程度;
B.叠氮酸(HN3)与醋酸酸性相近为弱酸,则N3-离子水解溶液显碱性;
C.向氨水中逐滴滴入盐酸至溶液的pH=7,结合溶液中存在电荷守恒分析判断;
D.0.02 mol/L的NaOH溶液与0.02 mol/L的NaHC2O4溶液等体积混合液得到溶液为N|a2C2O4,溶液中存在质子守恒,水电离出氢氧根离子浓度等于溶液中氢离子存在形式浓度总和.
解答 解:A.0.2 mol•L-1的NaHCO3溶液中pH>7,溶液显示碱性说明HCO3-水解程度大于其电离程度,溶液中:c(H2CO3)>c(CO32-),故A正确;
B.叠氮酸(HN3)与醋酸酸性相近为弱酸,则N3-离子水解溶液显碱性,水溶液中离子浓度大小顺序为:c(Na+)>c(N3-)>c(OH-)>c(H+),故B正确;
C.向氨水中逐滴滴入盐酸至溶液的pH=7,c(OH-)=c(H+),溶液中存在电荷守恒,c(NH4+)+c(H+)=c(Cl-)+c(OH-),则混合液中c(NH4+)=c(Cl-),故C正确;
D.0.02 mol/L的NaOH溶液与0.02 mol/L的NaHC2O4溶液等体积混合液得到溶液为N|a2C2O4,溶液中存在质子守恒,c(OH-)=2c(H2C2O4)+c(HC2O4-)+c(H+),故D错误;
故选D.
点评 本题考查了盐类水解、离子浓度大小比较、电荷守恒和物料守恒分析,掌握基础是解题关键,题目难度中等.

练习册系列答案
 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案
相关题目
8.今有两种正盐的稀溶液,分别是a mol/LNaX溶液和b mol/LNaY溶液,下列说法不正确的是( )
| A. | 若a>b,且c(X-)=c(Y-),则相同浓度时,酸性HX<HY | |
| B. | 若a=b,pH(NaX)>pH(NaY),则相同条件时,酸性HX<HY | |
| C. | 若a=b,且c(X-)=c(Y-)+c(HY),则相同条件时,酸性HX<HY | |
| D. | 若等体积混合,且c(X-)+c(Y-)+c(HX)+c(HY)=0.1mol/L,则一定有a+b=0.2mol/L |
15.下列离子或分子能够在指定的分散系中大量共存的是( )
| A. | 空气中:SO2、NO、N2、NH3 | |
| B. | 明矾溶液中:Na+、K+、CH3COO-、HCO3- | |
| C. | 过量铁与稀硫酸反应后的溶液中:[Fe(CN)6]3-、NH4+、Cl-、NO3- | |
| D. | 常温下,水电离出的c(H+)=1×10-12mol/L的溶液中:Ba2+、Na+、Cl-、NO3- |
4. 连二次硝酸(H2N2O2)是一种二元酸.常温下,向10mL 0.01mol•L-1的H2N2O2溶液滴加0.01mol/L的NaOH溶液,测得H2N2O2溶液pH与NaOH溶液体积的关系如图所示.下列说法正确的是( )
连二次硝酸(H2N2O2)是一种二元酸.常温下,向10mL 0.01mol•L-1的H2N2O2溶液滴加0.01mol/L的NaOH溶液,测得H2N2O2溶液pH与NaOH溶液体积的关系如图所示.下列说法正确的是( )
 连二次硝酸(H2N2O2)是一种二元酸.常温下,向10mL 0.01mol•L-1的H2N2O2溶液滴加0.01mol/L的NaOH溶液,测得H2N2O2溶液pH与NaOH溶液体积的关系如图所示.下列说法正确的是( )
连二次硝酸(H2N2O2)是一种二元酸.常温下,向10mL 0.01mol•L-1的H2N2O2溶液滴加0.01mol/L的NaOH溶液,测得H2N2O2溶液pH与NaOH溶液体积的关系如图所示.下列说法正确的是( )| A. | 由a点到n点水的电离程度依次增大 | |
| B. | a点时,c (H2N2O2)>c (Na+) | |
| C. | m点时,c(OH-)+c(N2O22-)=c(H2N2O2)+c (H+) | |
| D. | m点到n点,$\frac{{c({N_2}{O_2}^{2-})}}{{c(H{N_2}{O_2}^-)•c(O{H^-})}}$比值增大 |
8.金属冶炼中不会涉及到的反应类型是( )
| A. | 氧化还原反应 | B. | 置换反应 | C. | 热分解反应 | D. | 复分解反应 |
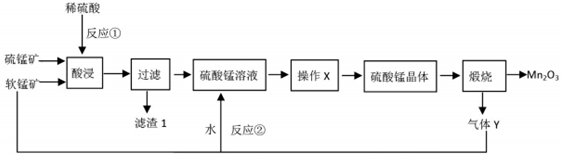



 .
. .
. 有多种同分异构体,试写出所有苯环上含有1个醛基和2个羟基,且核磁共振氢谱显示为4组峰的芳香族化合物的结构简式
有多种同分异构体,试写出所有苯环上含有1个醛基和2个羟基,且核磁共振氢谱显示为4组峰的芳香族化合物的结构简式 .
.