题目内容
25℃时,在1L的密闭容器中充入NO2发生如下反应:2NO2(g)?N2O4(g)△H=-57kJ?mol-1(N2O4在25℃时为无色气体).
(1)该反应的△S
(2)当开始充入0.03mol的NO2时,25℃时,实验测得NO2的平衡浓度为0.01mol?L-1,则NO2的平衡转化率(α)是
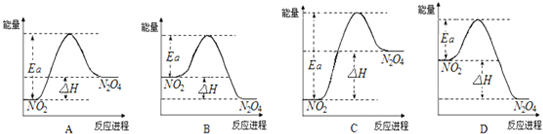
(3)25℃时,实验测得该反应的活化能Ea=92.4kJ?mol-1.下列能量关系图合理的是
(4)如把该密闭容器放入80℃的热水中,则气体的颜色
(1)该反应的△S
<
<
0(填“>”、“<”或“=”).(2)当开始充入0.03mol的NO2时,25℃时,实验测得NO2的平衡浓度为0.01mol?L-1,则NO2的平衡转化率(α)是
66.7%
66.7%
.25℃时上述反应的平衡常数K=100L/mol
100L/mol
.(3)25℃时,实验测得该反应的活化能Ea=92.4kJ?mol-1.下列能量关系图合理的是
B
B
.(4)如把该密闭容器放入80℃的热水中,则气体的颜色
加深
加深
(填“不变”、“加深”或“变浅”),NO2的转化率减小
减小
(填“增大”、“不变”或“减小”).
分析:(1)依据反应是气体体积减小的反应判断熵变;
(2)依据化学平衡的三段式列式计算平衡浓度,结合平衡常数、反应物转化率概念计算得到;
(3)依据反应是放热反应,二氧化氮能量高于四氧化二氮分析,结合图象分析活化能数值大于反应焓变判断;
(4)反应是放热反应,根据影响化学平衡的因素判断移动方向,结合二氧化氮是红棕色气体,四氧化二氮是无色气体分析判断.
(2)依据化学平衡的三段式列式计算平衡浓度,结合平衡常数、反应物转化率概念计算得到;
(3)依据反应是放热反应,二氧化氮能量高于四氧化二氮分析,结合图象分析活化能数值大于反应焓变判断;
(4)反应是放热反应,根据影响化学平衡的因素判断移动方向,结合二氧化氮是红棕色气体,四氧化二氮是无色气体分析判断.
解答:解:(1)2NO2(g)?N2O4(g)△H=-57kJ?mol-1,依据反应分析可知反应后气体体积减小,所以熵变小于0,△S<0,故答案为:<;
(2)在1L的密闭容器中充入NO2发生如下反应:2NO2(g)?N2O4(g)△H=-57kJ?mol-1,当开始充入0.03mol的NO2时,25℃时,实验测得NO2的平衡浓度为0.01mol?L-1,依据化学平衡三段式列式计算:二氧化氮起始浓度为0.03mol/L,
2NO2(g)?N2O4(g)
起始量(mol/L) 0.03 0
变化量(mol/L) 0.02 0.01
平衡量(mol/L) 0.01 0.01
NO2的平衡转化率(α)=
×100%=66.7%,
平衡常数K=
=
=100L/mol;
故答案为:66.7%;100L/mol;
(3)依据反应是放热反应,二氧化氮能量高于四氧化二氮分析,结合图象分析活化能数值大于反应焓变判断,B符合;AC中二氧化氮能量低于四氧化二氮,错误;D选项活化能数值小于反应焓变,错误;故答案为:B;
(4)2NO2(g)?N2O4(g)△H=-57kJ?mol-1,反应是放热反应,二氧化氮是红棕色气体,四氧化二氮是无色气体,放在80℃的热水中,平衡逆向进行,气体颜色加深,NO2的转化率减小;故答案为:加深;减小.
(2)在1L的密闭容器中充入NO2发生如下反应:2NO2(g)?N2O4(g)△H=-57kJ?mol-1,当开始充入0.03mol的NO2时,25℃时,实验测得NO2的平衡浓度为0.01mol?L-1,依据化学平衡三段式列式计算:二氧化氮起始浓度为0.03mol/L,
2NO2(g)?N2O4(g)
起始量(mol/L) 0.03 0
变化量(mol/L) 0.02 0.01
平衡量(mol/L) 0.01 0.01
NO2的平衡转化率(α)=
| 0.02mol/L |
| 0.03mol/L |
平衡常数K=
| [N2O4] |
| [NO2]2 |
| 0.01mol/L |
| (0.01mol/L)2 |
故答案为:66.7%;100L/mol;
(3)依据反应是放热反应,二氧化氮能量高于四氧化二氮分析,结合图象分析活化能数值大于反应焓变判断,B符合;AC中二氧化氮能量低于四氧化二氮,错误;D选项活化能数值小于反应焓变,错误;故答案为:B;
(4)2NO2(g)?N2O4(g)△H=-57kJ?mol-1,反应是放热反应,二氧化氮是红棕色气体,四氧化二氮是无色气体,放在80℃的热水中,平衡逆向进行,气体颜色加深,NO2的转化率减小;故答案为:加深;减小.
点评:本题考查了反应焓变和熵变判断,化学平衡的三段式计算应用,反应为转化率、反应平衡常数概念的计算应用,平衡影响因素的分析判断,题目难度中等.

练习册系列答案
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
相关题目
(12分)在不同温度下,反应CO2(g)+H2(g) CO(g)+H2O(g)的平衡常数K如下表:
CO(g)+H2O(g)的平衡常数K如下表:
| 温度/℃ | 700 | 800 | 850 | 1000 | 1200 |
| 平衡常数K | 2.6 | 1.7 | 1 | 0.9 | 0.6 |
(2)850℃时发生上述反应,CO2的转化率随时间变化如图所示。其他条件相同时,请在下图中画出700℃时CO2的转化率随时间变化的示意图(注明必要的标示)。

(3)在850℃时发生上述反应,以下表中的物质的量投入恒容反应器,其中向正方向移动的组是 (填代号),平衡后与C中各物质的百分含量相等的组有__________(填代号 )
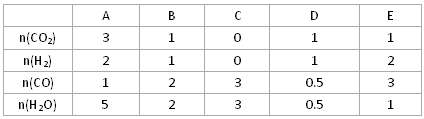
| | A | B | C | D | E |
| n(CO2)[ | 3 | 1 | 0 | 1 | 1 |
| n(H2) | 2 | 1 | 0 | 1 | 2 |
| n(CO) | 1 | 2 | 3 | 0.5 | 3 |
| n(H2O) | 5 | 2 | 3 | 0.5 | 1 |
(12分)在不同温度下,反应CO2(g)+H2(g) CO(g)+H2O(g)的平衡常数K如下表:
CO(g)+H2O(g)的平衡常数K如下表:
|
温度/℃ |
700 |
800 |
850 |
1000 |
1200 |
|
平衡常数K |
2.6 |
1.7 |
1 |
0.9 |
0.6 |
(1)该反应的△H 0。(填“>”、“=”或“<”)。若到达平衡后升高温度,则CO2的转化率将 ,正反应速率 (填“增大”、“减小”或“不变”)。
(2)850℃时发生上述反应,CO2的转化率随时间变化如图所示。其他条件相同时,请在下图中画出700℃时CO2的转化率随时间变化的示意图(注明必要的标示)。

(3)在850℃时发生上述反应,以下表中的物质的量投入恒容反应器,其中向正方向移动的组是 (填代号),平衡后与C中各物质的百分含量相等的组有__________(填代号 )
|
|
A |
B |
C |
D |
E |
|
n(CO2)[ |
3 |
1 |
0 |
1 |
1 |
|
n(H2) |
2 |
1 |
0 |
1 |
2 |
|
n(CO) |
1 |
2 |
3 |
0.5 |
3 |
|
n(H2O) |
5 |
2 |
3 |
0.5 |
1 |
(4) 850℃时,在1L的密闭容器中分别充入2mol的CO2和H2,计算反应到达平衡时CO的物质的量浓度。(写出计算过程)
 CO(g)+H2O(g)的平衡常数K如下表:
CO(g)+H2O(g)的平衡常数K如下表: