题目内容
【题目】25℃时,现有浓度均为0.10mol·L-1的两种溶液:①CH3COOH溶液、②NaOH溶液。请回答:
(1)溶液①的pH __________(填“>”“=”或“<”)1,原因是______________。
(2)将等体积①和②混合,所得溶液显__________(填“酸”“碱”或“中”)性,原因是__________________(用离子方程式表示)。
(3)向①中逐滴加入②至所得溶液pH=7的过程中(不含pH=7时的溶液),下列关系正确的是_________(填选项序号)。
a.c(H+)>c(OH-)
b.c(Na+)<c(CH3COO-)
C.c(Na+) =c(CH3COO-)+c(CH3COOH)
d.c(OH-) +c(CH3COO-) =c(H+) +c(Na+)
【答案】(1)>,CH3COOH在水溶液中只有部分电离成H+和CH3COO-;
(2)碱,CH3COO-+H2O![]() CH3COOH+OH-;(3)abd
CH3COOH+OH-;(3)abd
【解析】
试题分析:(1)CH3COOH是弱电解质,部分电离,CH3COOH![]() CH3COO-+H+,因此pH<1;(2)①②恰好反应,生成物质CH3COONa,属于强碱弱酸盐,CH3COO-+H2O
CH3COO-+H+,因此pH<1;(2)①②恰好反应,生成物质CH3COONa,属于强碱弱酸盐,CH3COO-+H2O![]() CH3COOH+OH-,溶液显碱性;(3)a、当pH=7溶液中的溶质为CH3COOH、CH3COONa,向醋酸溶液中滴加NaOH溶液,c(H+)>c(OH-),故正确;b、当pH=7时,c(Na+)=c(CH3COO-),但溶液不包括pH=7,醋酸始终过量,因此有c(Na+)<c(CH3COO-),故正确;c、滴加过程中始终c(CH3COO-)+c(CH3COOH)>c(Na+),故错误;d、根据溶液电中性,c(OH-)+C(CH3COO-)=c(H+)+c(Na+),故正确。
CH3COOH+OH-,溶液显碱性;(3)a、当pH=7溶液中的溶质为CH3COOH、CH3COONa,向醋酸溶液中滴加NaOH溶液,c(H+)>c(OH-),故正确;b、当pH=7时,c(Na+)=c(CH3COO-),但溶液不包括pH=7,醋酸始终过量,因此有c(Na+)<c(CH3COO-),故正确;c、滴加过程中始终c(CH3COO-)+c(CH3COOH)>c(Na+),故错误;d、根据溶液电中性,c(OH-)+C(CH3COO-)=c(H+)+c(Na+),故正确。

 优生乐园系列答案
优生乐园系列答案【题目】下表各组物质之间通过一步反应不可以实现如下图所示转化关系的是
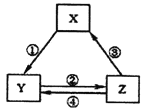
选项 | X | Y | Z | 箭头上所标数字的反应条件 |
A | Na2O2 | NaOH | NaCl | ①常温遇水 |
B | AlCl3 | NaAlO2 | Al(OH)3 | ②通入CO2 |
C | NO | NO2 | HNO3 | ④加入铜粉 |
D | Cl2 | NaClO | HClO | ③加浓盐酸 |