题目内容
【题目】乙酸苯甲酯是一种难溶于水,密度大于水的无色油状液体,具有茉莉花气味,可用做调香剂。
(一)以乙烯,甲苯为原料,合成乙苯甲酯的路线如图所示。

(1)写出由乙烯制备A的化学方程式______。
(2)写出生成乙酸苯甲酯的化学方程式______。
(3)C到苯甲醇的反应类型______。
(二)制备乙酸苯甲酯的流程如图:
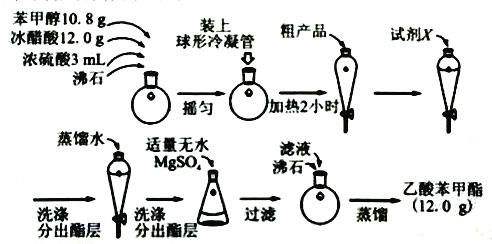
(4)球形冷凝管的作用为______。
(5)试剂X可为______。
A.氢氧化钠溶液 B.碳酸钠溶液 C.乙醇 D.氯化钠溶液
(6)分出酯层时应收集______层液体(填“上”或“下”)
(7)无水MgSO4的作用为______。
(8)本实验所得乙酸苯甲酯的产率为______。(已知:相对分子量:苯甲醇:108;乙酸:60;乙酸苯甲酯:150)。
【答案】CH2=CH2+H2O![]() CH3CH2OH CH3COOH+
CH3CH2OH CH3COOH+![]()
![]()
![]() +H2O 水解反应或取代反应 冷凝回流 B 下 干燥
+H2O 水解反应或取代反应 冷凝回流 B 下 干燥 ![]()
【解析】
(一)乙烯与水发生加成反应生成A为乙醇,由乙酸苯甲酯的结构可知,乙醇发生催化氧化生成B为CH3COOH,甲苯与氯气发生取代反应生成![]() ,
,![]() 发生水解反应生成苯甲醇(
发生水解反应生成苯甲醇(![]() ),乙酸与苯甲醇发生酯化反应得到乙酸苯甲酯(
),乙酸与苯甲醇发生酯化反应得到乙酸苯甲酯(![]() )。
)。
(1)乙烯与水发生加成反应产生乙醇,制备A的化学方程式:CH2=CH2+H2O![]() CH3CH2OH;
CH3CH2OH;
(2)乙酸与苯甲醇在浓硫酸存在的条件下发生酯化反应,产生乙酸苯甲酯和水,反应方程式为:CH3COOH+![]()
![]()
![]() +H2O;
+H2O;
(3)C是![]() ,
,![]() 到苯甲醇发生的是卤代烃的水解反应,也属于取代反应;
到苯甲醇发生的是卤代烃的水解反应,也属于取代反应;
(二)(4)有机物易挥发,冷凝管起冷凝回流作用,从而可提高原料的利用率;
(5)加入试剂X吸收乙酸,注意要防止酯发生水解,可以选择碳酸钠溶液,故合理选项是B;
(6)乙酸苯甲酯的密度比水的大,分出酯层时应收集下层液体;
(7)分离出的酯层含有水,硫酸镁具有吸水性,用硫酸镁进行干燥;
(8)10.8g苯甲醇的物质的量为n(苯甲醇)=10.8g÷108g/mol=0.1mol,12g乙酸的物质的量为n(乙酸)=12g÷60g/mol=0.2mol,二者发生酯化反应的物质的量的比是1:1,所以乙酸过量,则生成乙酸苯甲酯为0.1mol,即理论产量为0.1mol×150g/mol=15g,本实验所得乙酸苯甲酯的产率为![]() ×100%=80%。
×100%=80%。

 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案