题目内容
【题目】铬是一种具有战略意义的金属,它具有多种价态,单质铬熔点为1857℃。
(1)工业上以铬铁矿[主要成分是Fe(CrO2)2]为原料冶炼铬的流程如图所示:
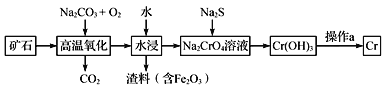
①Fe(CrO2)2中各元素化合价均为整数,则铬为_______价。
②高温氧化时反应的化学方程式为___________________________________。
(2)Cr(OH)3是两性氢氧化物,请写出其分别与NaOH、稀硫酸反应时生成的两种盐的化学式_______。
(3)铬元素能形成含氧酸及含氧酸盐,若测得初始浓度为1 mol·L-1的铬酸(H2CrO4)溶液中各种含铬元素的微粒浓度分别为:c(CrO42-)=0.0005 mol·L-1、c(HCrO4-)=0.1035 mol·L-1、c(Cr2O72-)=a mol·L-1、则a=______,KHCrO4溶液中c(OH-)______c(H+)(填“>”、“<”或“=”)。
(4)水中的铬元素对水质及环境均有严重的损害作用,必须进行无害化处理。
①处理含有Cr2O72-的污水方法通常为:用铁作电极电解污水,Cr2O72-被阳极区生成的离子还原成为Cr3+,生成的Cr3+与阴极区生成的OH结合生成Cr(OH)3沉淀除去。则阴极上的电极反应式为________________________,若要处理含10 mol Cr2O72-的污水,则至少需要消耗的铁为_______g。
②转化为重要产品磁性铁铬氧体(CrxFeyOz):先向含CrO42-的污水中加入适量的硫酸及硫酸亚铁,待充分反应后再通入适量空气(氧化部分Fe2+)并加入NaOH,就可以使铬、铁元素全部转化为磁性铁铬氧体。写出CrO42-在酸性条件下被Fe2+还原为Cr3+的离子方程式___________________。
【答案】+3 4Fe(CrO2)2+7O2+8Na2CO3![]() 2Fe2O3+8Na2CrO4+8CO2 NaCrO2、Cr2(SO4)3 0.448 < 2H2O+2e-=2OH-+H2↑(或者2H++2e-=H2↑) 3360 3Fe2++CrO42-+8H+=3Fe3++Cr3++4H2O
2Fe2O3+8Na2CrO4+8CO2 NaCrO2、Cr2(SO4)3 0.448 < 2H2O+2e-=2OH-+H2↑(或者2H++2e-=H2↑) 3360 3Fe2++CrO42-+8H+=3Fe3++Cr3++4H2O
【解析】
铬铁矿中加入碳酸钠并通入氧气,高温下将Fe(CrO2)2氧化得到Fe2O3、Na2CrO4,同时生成CO2,将得到的固体溶于水得到Na2CrO4溶液,然后过滤,向滤液中加入硫化钠,硫化钠和Na2CrO4发生氧化还原反应生成Cr(OH)3沉淀,过滤后灼烧Cr(OH)3得到Cr2O3,利用铝热反应制备金属铬,据此解答。
(1)①Fe(CrO2)2中各元素化合价均为整数,由于氧元素显-2价,铁显+2价,则根据正负价代数和为0可知铬为+3。
②高温氧化时,Fe(CrO2)2和碳酸钠、氧气发生氧化还原反应生成Na2CrO4、二氧化碳和氧化铁,该反应中Fe元素化合价由+2价变为+3价、Cr元素化合价由+3价变为+6价,O元素化合价由0价变为-2价,所以氧气是氧化剂、Fe(CrO2)2是还原剂,依据原子守恒、转移电子守恒配平后的化学方程式为4Fe(CrO2)2+7O2+8Na2CO3![]() 2Fe2O3+8Na2CrO4+8CO2。
2Fe2O3+8Na2CrO4+8CO2。
(2)Cr(OH)3是两性氢氧化物,依据氢氧化铝的性质可类推知其分别与NaOH、稀硫酸反应时生成的两种盐的化学式为NaCrO2、Cr2(SO4)3。
(3)根据Cr原子守恒可知c(CrO42-)+c(HCrO4-)+2c(Cr2O72-)=1mol/L,解得a=0.448;由于HCrO4-的电离程度大于其水解程度,则KHCrO4溶液显酸性,因此溶液中c(OH-)<c(H+)。
(4)①电解池中阴极发生得到电子的还原反应,则溶液中的氢离子在阴极放电,电极反应式为2H++2e-=H2↑。10mol Cr2O72-在反应中得到60mol电子,阳极上产生的亚铁离子就需要提供60mol电子,因此根据原子守恒可知需要铁是60mol,质量是60mol×56g/mol=3360g;
②CrO42-在酸性条件下被Fe2+还原为Cr3+,Cr元素化合价从+6价降低到+3价得到3个电子,铁元素化合价从+2价升高到+3价失去1个电子,根据得失电子守恒、原子守恒以及电荷守恒可知反应的离子方程式为3Fe2++CrO42-+8H+=3Fe3++Cr3++4H2O。







