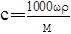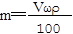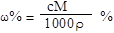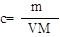题目内容
向60 mL Na2SO4溶液中加入BaCl2溶液,有关数据见下表: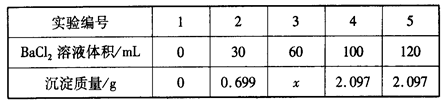
下列有关说法不正确的是
| A.混合前,BaCl2溶液的物质的量浓度为0.10 mol·L-1 |
| B.混合前,Na2SO4溶液的物质的量浓度为0.15 mol·L-1 |
| C.3号实验中沉淀的质量x为1.398 g |
| D.完全沉淀60 mL Na2SO4溶液消耗BaCl2溶液的体积为80 mL |
D
解析试题分析:根据加入100mL氯化钡溶液生成2.097g沉淀,沉淀质量大于加入30mL氯化钡溶液时所产生沉淀质量,据此可判断加入30mL氯化钡溶液时,混合溶液中的硫酸钠未完全反应,则向混合溶液中加入氯化钡溶液完全反应可生成硫酸钡沉淀质量比=30mL:0.699g;按此关系,若分别加入60mL氯化钡溶液完全反应,应得到硫酸钡沉淀为x= 60mL/30mL×0.699g=1.398g,完全沉淀60 mL Na2SO4溶液应生成2.097g恰好生成2.097g沉淀需氯化钡溶液的体积为2.097g/0.699g×30mL=90mL。故D错误。
考点:考查物质的量的有关计算等相关知识。

 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案下列说法正确的是( )
| A.0.5mol SO2和11.2LCO2所含的分子数目一定相等 |
| B.25℃和100℃时,水的pH相等 |
| C.中和等体积、等物质的量浓度的NaOH和氨水所消耗的n(H2SO4)相等 |
D.2SO2(g)+O2(g) 2SO3(g) 和4SO2(g)+2O2(g) 2SO3(g) 和4SO2(g)+2O2(g) 4SO3(g)的△H相等 4SO3(g)的△H相等 |
下列叙述中正确的是
①标准状况下,1LHCl和1LH2O的物质的量相同
②标准状况下,1gH2和14gN2的体积相同
③28gCO的体积为22.4L
④两种物质的物质的量相同,则它们在标准状况下的体积也相同
⑤在同温同体积时,气体物质的物质的量越大,则压强越大
⑥同温同压下,气体的密度与气体的相对分子质量成正比
| A.①②③ | B.④⑤⑥ | C.②③⑥ | D.②⑤⑥ |
用NA表示阿伏加德罗常数,下列说法中正确的是
| A.1 molNa与足量氧气反应转移电子数一定为NA |
| B.标准状况下,22.4 LCHCl3中含有的分子数为NA |
| C.1mol·L-1Na2CO3溶液中含有2NA个Na+ |
| D.常温常压下,71g37Cl2含有NA个37Cl2分子 |
用98%的浓硫酸(密度为1.84g/cm3配制100mL 1 mol/L的稀硫酸,现给出下列仪器(配制过程中可能用到):①100mL量筒 ②10mL量筒 ③50mL烧杯 ④托盘天平 ⑤100mL容量瓶 ⑥胶头滴管 ⑦玻璃棒,配制中使用仪器的先后顺序排列正确的是( )
| A.④③⑦⑤⑥ | B.②⑤⑦⑥ | C.①③⑤⑥⑦ | D.②⑥③⑦⑤⑥ |
设NA为阿伏伽德罗常数的值,下列叙述正确的是
| A.1 molCl2与足量Fe反应转移电子数一定为3NA |
| B.标准状况下,2.24 L NH3中含有共价键的数目为NA |
| C.1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3 NA |
| D.标况下,11.2 L HF所含的分子数目为0.5NA |
用NA表示阿伏德罗常数,下列叙述正确的是( )
| A.标准状况下,22.4 L H2O含有的分子数为NA |
| B.常温常压下,1.06g Na2CO3含有的Na+ 离子数为 0.02 NA |
| C.通常状况下, NA个CO2分子占有的体积为 22.4L |
| D.物质的量浓度为 0.5mol/L 的 MgCl2 溶液中,含有Cl-个数为NA |
合成氨工业生产中所用的α—Fe催化剂的成分是FeO、Fe2O3,当催化剂中Fe2+与Fe3+的物质的量之比为1:2时,其催化活性最高,此时混合物中铁的质量分数约为
| A.70.0% | B.77.8% | C.72.4% | D.75.0% |