题目内容
填空回答:
(1)在实验室里,当向一种未知试液里加入足量___________,此时无沉淀出现,再加入__________,如果有白色沉淀出现,则可以确证原试液中有存在SO42-。该实验中肯定发生的反应的离子方程式为
______________________。
(2)盛放烧碱溶液的玻璃试剂瓶不能用玻璃塞,是为了防止发生___________________________反应(用化学方程式表示),而使瓶塞与瓶口粘在一起。
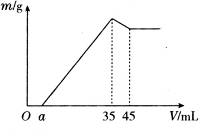
(3)在40mL0.10mol/LBaCl2溶液中,加入VmL 0.10mol/L H2SO4溶液(过量),使沉淀完全。将反应后的混合物过滤,取滤液的一半,在滤液中加入25mL 0.20mol/L NaOH溶液,恰好至呈中性。则V=________。
(1)盐酸;BaCl2溶液;Ba2++SO42-==BaSO4↓
(2)
(3)50mL
(2)

(3)50mL

练习册系列答案
 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案
相关题目
下表数据是在某高温下,金属镁和镍分别在氧气中进行氧化反应时,在金属表面生成氧化薄膜的实验记录:
反应时间t/h | 1 | 4 | 9 | 16 | 25 |
MgO层厚Y/nm | 0.05a | 0.20a | 0.45a | 0.80a | 1.25a |
NiO层厚Y′/nm | B | 2b | 3b | 4b | 5b |
注:a和b均为与温度有关的常数。
请填空回答:
(1)金属高温氧化腐蚀速率可以用金属氧化膜的生长速率来表示,其理由是___________
_________________________________________________________。
(2)金属氧化膜厚Y跟时间t所呈现的关系是(填“直线、抛物线、对数或双曲线”等类型):MgO氧化膜的膜厚Y属_________型;NiO氧化膜的膜厚Y′属_________型。
(3)Mg与Ni比较,哪一种金属具有更良好的耐氧化腐蚀性:_____________________,其理由是_____________________________________________________________。