题目内容
(8分)某校研究性学习小组用相同大小的铜片和锌片为电极研究水果电池,得到的实验数据如下表所示:(已知果汁是显酸性的)

(1)该实验的目的是探究水果种类和_______________对水果电池电流大小的影响。
(2)能表明水果种类对电流大小有影响的实验编号是 和 __________。
__________。
(3)上图所示的装置中,负极的电极反应式为 ,正极附近区域的C(H+)将 (填“增大”、“减小”、“不变”),总反应离子方程式为 。
| 实验编号 | 水果种类 | 电极间距离/㎝ | 电流大小/µA |
| ① | 西红柿 | 1 | 98.7 |
| ② | 西红柿 | 2 | 72.5 |
| ③ | 苹 果 | 2 | 27.2 |

(1)该实验的目的是探究水果种类和_______________对水果电池电流大小的影响。
(2)能表明水果种类对电流大小有影响的实验编号是 和
 __________。
__________。(3)上图所示的装置中,负极的电极反应式为 ,正极附近区域的C(H+)将 (填“增大”、“减小”、“不变”),总反应离子方程式为 。
(每空2分)(1)电极间距离 (1分)
(2)②③ (2分)(两空都对才给分)
(3)Zn-2e—=Zn2+ (2分) 减小(1分) Zn+2H+=H2↑+ Zn2+(2分)
(2)②③ (2分)(两空都对才给分)
(3)Zn-2e—=Zn2+ (2分) 减小(1分) Zn+2H+=H2↑+ Zn2+(2分)
略

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 Mx(g),反应物和生成物的物质的量随时间的变化关系如下图。下 列说法正确的是
Mx(g),反应物和生成物的物质的量随时间的变化关系如下图。下 列说法正确的是 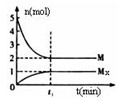
 将增大
将增大

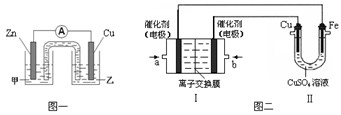
 乙、丙同学对甲的设计分别做了改进后,灯泡亮了。根据上述素材,回答以下问题:
乙、丙同学对甲的设计分别做了改进后,灯泡亮了。根据上述素材,回答以下问题:
 ,如果他的铁片更换,你认为可以换成 (化学式)
,如果他的铁片更换,你认为可以换成 (化学式)
 ,负极电极反应式为:
,负极电极反应式为: ,只要将灯放入海水中,数分钟后就会发出耀眼的光,其能量比电池高20~50倍。
,只要将灯放入海水中,数分钟后就会发出耀眼的光,其能量比电池高20~50倍。