题目内容
某二元弱酸(简写为H2A)溶液,按下式发生一级和二级电离:H2A![]() H++HA-,HA-
H++HA-,HA-![]() H++A2-,已知相同浓度时的电离度α(H2A)>α(HA-).设有下列四种溶液:A为0.01mol·L-1的H2A溶液,B为0.01mol·L-1的NaHA溶液,C为0.02mol·L-1的HCl与0.04mol·L-1的NaHA溶液等体积混合液,D为0.02mol·L-1的NaOH与0.02mol·L-1NaHA溶液等体积混合液.据此,填写下列各空白(填代号):
H++A2-,已知相同浓度时的电离度α(H2A)>α(HA-).设有下列四种溶液:A为0.01mol·L-1的H2A溶液,B为0.01mol·L-1的NaHA溶液,C为0.02mol·L-1的HCl与0.04mol·L-1的NaHA溶液等体积混合液,D为0.02mol·L-1的NaOH与0.02mol·L-1NaHA溶液等体积混合液.据此,填写下列各空白(填代号):
(1)[H+]最大的是________,最小的是________.
(2)[H2A]最大的是________,最小的是________.
(3)[A2-]最大的是________,最小的是________.
解析:
|
(1)A,D;(2)C,D;(3)D,A 【巧解导析】对A,B,C,D四种溶液中溶质的电离情况进行分析如下: A中:H2A B中:HA- C中:其溶质为NaCl及0.01mol·L-1的H2A及0.01mol·L-1的NaHA.由于NaHA为强电解质,故H2A的电离受到抑制. D中:溶质为0.01mol·L-1的Na2A及0.01mol·L-1的NaHA.Na2A为强电解质,电离出0.01mol·L-1的A2-.由于H2A为二元弱酸,故A2-水解使溶液呈碱性,它使HA-的水解受到抑制. |
提示:
|
【巧解点悟】由于H2A为二元弱酸,其两级电离都存在电离平衡.解题关键点:要抓住电离平衡的移动方向,弄清离子浓度的细小差别.解题易错点为:若不能认识到HA-对H2A电离的抑制及A2-的水解对HA-水解的抑制,就可能出错. |

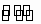 H++HA-,HA-
H++HA-,HA- H++HA-,
HA-
H++HA-,
HA-