题目内容
【题目】某实验小组研究可逆反应AsO43—+2I—+2H+![]() AsO33—+I2+H2O时,设计了如图所示的原电池:
AsO33—+I2+H2O时,设计了如图所示的原电池:

(1)电池工作时,盐桥中的阴离子向 极移动(填C1或C2);若向B池里滴加NaOH溶液,平衡向 方向移动,此时C2极的电极反应式为 。
(2)下列判断正确的是 。
a.微安表指针为0时,该反应处于平衡状态。
b.向A池中加入淀粉溶液,溶液变蓝说明该反应处于平衡状态。
c.AsO43—、AsO33—离子浓度相等时,该反应处于平衡状态。
(3)若在5min时间内电路中通过了1.204×104库伦电量,用I—浓度的变化来表示的化学反应速率为 。
(4)该反应的平衡常数表达式K= 。若升高温度,K值增大,则正反应的△H 0。(填“>”、“<”或“=”)
(5)已知反应达到平衡时,AsO43—离子转化率为25%,则I—离子的转化率 。
a.大于25% b.小于25%
c.等于25% d无法确定
(6)反应达到平衡后,若将AsO43—、I—、H+、AsO33—、I2的浓度均减少到原来的一半,上述平衡向 方向移动。
【答案】(1)C1;逆反应或左,AsO33—-2e—+H2O=AsO43—+2H+ 或AsO33—+H2O=AsO43—+2H++2e—
(2)a (3)0.05 mol ·L—1 ·min—1(4)c(AsO33—)· c(I2)/c(AsO43—)· c2(I—)· c2(H+)。>。
(5)d(6)逆反应或左
【解析】
试题分析:(1)根据反应:AsO43—+2I—+2H+![]() AsO33—+I2+H2O知电池工作时,碘离子失去电子,发生氧化反应,则A中C1是原电池的负极,盐桥中的阴离子向负极C1移动;若向B池里滴加NaOH溶液,氢氧根和氢离子反应,溶液中氢离子浓度降低,平衡向逆反应方向移动,此时C2极的电极反应式为AsO33—-2e—+H2O=AsO43—+2H+ 或AsO33—+H2O=AsO43—+2H++2e—。
AsO33—+I2+H2O知电池工作时,碘离子失去电子,发生氧化反应,则A中C1是原电池的负极,盐桥中的阴离子向负极C1移动;若向B池里滴加NaOH溶液,氢氧根和氢离子反应,溶液中氢离子浓度降低,平衡向逆反应方向移动,此时C2极的电极反应式为AsO33—-2e—+H2O=AsO43—+2H+ 或AsO33—+H2O=AsO43—+2H++2e—。
(2)a.微安表指针为0时,该反应处于平衡状态,正确;b.向A池中加入淀粉溶液,溶液变蓝说明有碘单质存在,但该反应不一定处于平衡状态,错误;c.AsO43—、AsO33—离子浓度相等时,该反应不一定处于平衡状态,错误,选a。
(3)若在5min时间内电路中通过了1.204×104库伦电量,则电子的物质的量是![]() ,所以碘离子的浓度变化量为0.125mol÷0.5L=0.25mol/L,所以用I—浓度的变化来表示的化学反应速率为0.25mol/L÷5min=0.05 mol ·L—1 ·min—1。
,所以碘离子的浓度变化量为0.125mol÷0.5L=0.25mol/L,所以用I—浓度的变化来表示的化学反应速率为0.25mol/L÷5min=0.05 mol ·L—1 ·min—1。
(4)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,则根据该方程式可知该反应的平衡常数表达式K= c(AsO33—)· c(I2)/c(AsO43—)· c2(I—)· c2(H+)。若升高温度,K值增大,说明升高温度平衡向正反应方向减小,则正反应的△H>0。
(5)由于不能确定碘离子的起始量,所以不能计算其转化率,答案选d。
(6)反应达到平衡后,若将AsO43—、I—、H+、AsO33—、I2的浓度均减少到原来的一半,则根据平衡常数表达式可知浓度熵增大,因此上述平衡向逆反应方向移动。

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案【题目】某学习小组研究影响锌与稀硫酸反应速率的外界条件,设计实验的数据如下:
实验序号 | 锌的质量/g | 锌的状态 | c(H2SO4)/mol·L-1 | V(H2SO4)/mL | 反应前溶液的温度/℃ | 其他试剂 |
1 | 0.65 | 粒状 | 0.5 | 50 | 20 | 无 |
2 | 0.65 | 粉末 | 0.5 | 50 | 20 | 无 |
3 | 0.65 | 粒状 | 0.5 | 50 | 20 | 2滴CuSO4溶液 |
4 | 0.65 | 粉末 | 0.8 | 50 | 20 | 无 |
5 | 0.65 | 粉末 | 0.8 | 50 | 35 | 2滴CuSO4溶液 |
(1)在此5组实验中,判断锌和稀硫酸反应速率大小,最简单的方法可通过测定 进行判断,其速率最快的是 (填实验序号)。
(2)实验1和2表明 对反应速率有影响;实验1和3表明 对反应速率有影响。
(3)进行实验2时,小组同学根据实验过程绘制的氢气体积(标准状况下)与时间的关系如图所示。
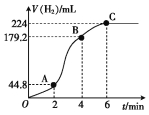
①在OA、AB、BC三段中反应速率最快的是 ,其原因是 。
②2~4 min内以硫酸的浓度变化表示的反应速率(假设溶液的体积不变)v(H2SO4)= mol·L-1·min-1。
【题目】甲醇是重要的化学工业基础原料和液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 | 平衡常数 | 温度(℃) | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 2.50 |
③3H2(g)+ CO2(g) | K3 | ||
(1)反应②是 (填“吸热”或“放热”)反应。

(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如图所示。则平衡状态由A变到B时,平衡常数K(A) K(B)(填“>”、“<”或“=”)。
(3)500℃ K3= ;反应③△H 0(填“>”“=”或“<”)
在500℃、2L的密闭容器中,进行反应③,测得某时刻H2、CO2、CH3OH、H2O的物质的量分别为6mol、2 mol、10 mol、10 mol,此时v(正) v(逆)(填“>”“=”或“<”)

(4)一定温度下,在3 L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。当曲线Ⅰ变为曲线Ⅱ时,改变的条件是 。当曲线Ⅰ变为曲线Ⅲspan>时,改变的条件是 。