��Ŀ����
����Ŀ������ԭCO2�ǽ������ЧӦ����Դ�������Ҫ�ֶ�֮һ���о���������Cu/ZnO���������£�CO2��H2�ɷ�������ƽ�з�Ӧ���ֱ�����CH3OH��CO����Ӧ���Ȼ�ѧ����ʽ���£�
CO2��g��+3H2��g��CH3OH��g��+H2O��g����H1=��53.7kJmol��1 ��
CO2��g��+H2��g��CO��g��+H2O��g����H2 ��
ijʵ���ҿ���CO2��H2��ʼͶ�ϱ�Ϊ1��2.2������ͬѹǿ�£�������ͬ��Ӧʱ��������ʵ�����ݣ�
T��K�� | ���� | CO2ת���ʣ�%�� | �״�ѡ���ԣ�%�� |
543 | Cat.1 | 12.3 | 42.3 |
543 | Cat.2 | 10.9 | 72.7 |
553 | Cat.1 | 15.3 | 39.1 |
553 | Cat.2 | 12.0 | 71.6 |
[��ע]Cat.1��Cu/ZnO���װ���Cat.2��Cu/ZnO����Ƭ���״�ѡ���ԣ�ת����CO2�����ɼ״��İٷֱ�
��֪����CO��H2�ı�ȼ���ȷֱ�Ϊ��283.0kJmol��1�ͩ�285.8kJmol��1 ��
��H2O��1���TH2O��g����H3=44.0kJmol��1
��ش𣨲������¶ȶԡ�H��Ӱ�죩��
��1����ӦI��ƽ�ⳣ������ʽK=����Ӧ��ġ�H2=kJmol��1 ��
��2�����������CO2ת��ΪCH3OHƽ��ת���ʵĴ�ʩ�� ��
A.ʹ�ô���Cat.1
B.ʹ�ô���Cat.2
C.���ͷ�Ӧ�¶�
D.Ͷ�ϱȲ��䣬���ӷ�Ӧ���Ũ��
E.���� CO2��H2�ij�ʼͶ�ϱ�
��3������ʵ�����ݱ���������ͬ�¶��²�ͬ�Ĵ�����CO2ת����CH3OH��ѡ������������Ӱ�죬��ԭ���� ��
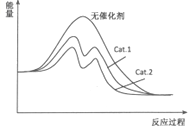
��4������ͼ�зֱ���ӦI����������Cat.1����Cat.2��������¡���Ӧ���̩�������ʾ��ͼ��
��5���о�֤ʵ��CO2Ҳ��������ˮ��Һ��ͨ��������ɼ״��������ɼ״��ķ�Ӧ�����������õ缫��Ӧʽ�� ��
���𰸡�
��1��![]() ��+41.2
��+41.2
��2��C,D
��3���������ݱ�����ʱδ�ﵽƽ�⣬��ͬ�Ĵ����Է�Ӧ��Ĵ�������ͬ������ٸ�ʱ���¶Լ״�ѡ������Ӱ��
��4��
��5������CO2+6H++6e��=CH3OH+H2O
����������1��ƽ�ⳣ��Ϊ������Ũ����֮���뷴Ӧ��Ũ����֮���ı�ֵ. ��֪��CO��H2�ı�ȼ���ȷֱ�Ϊ��283.0kJmol��1�ͩ�285.8kJmol��1 �� ��H2O��1���TH2O��g����H3=44.0kJmol��1 �� ��֪�Ȼ�ѧ����ʽa��CO��g��+ ![]() O2��g��=CO2��g����H=��283.0kJmol��1 �� b��H2��g��+
O2��g��=CO2��g����H=��283.0kJmol��1 �� b��H2��g��+ ![]() O2��g��=H2O��1����H=��285.8kJmol��1 �� c��H2O��1���TH2O��g����H3=44.0kJmol��1 ��
O2��g��=H2O��1����H=��285.8kJmol��1 �� c��H2O��1���TH2O��g����H3=44.0kJmol��1 ��
�ɸ�˹���ɽ�b��a+c�ɵ�CO2��g��+H2��g��CO��g��+H2O��g����H2 =����285.8+283.0+44��kJmol��1=+41.2kJmol��1 ��
���Դ��ǣ� ![]() ��+41.2��
��+41.2��
��2��A��ʹ�ô���Cat.1��ƽ�ⲻ�ƶ����������ת���ʣ���A����
B��ʹ�ô���Cat.2���������ת���ʣ���B����
C�����ͷ�Ӧ�¶ȣ�ƽ�������ƶ���������ת���ʣ���C��ȷ��
D��Ͷ�ϱȲ��䣬���ӷ�Ӧ���Ũ�ȣ��������ƶ���������ת���ʣ���D��ȷ��
E������ CO2��H2�ij�ʼͶ�ϱȣ�������������ת���ʣ�������̼��ת���ʼ�С����E����
���Դ��ǣ�CD��
��3���ӱ������ݷ���������ͬ�¶��£���ͬ�Ĵ���������̼��ת���ʲ�ͬ��˵����ͬ�Ĵ����Ĵ�������ͬ����ͬ�Ĵ�����ͬ���¶ȣ�������̼��ת���ʲ�ͬ�����¶ȸߵ�ת���ʴ���Ϊ����ӦΪ���ȷ�Ӧ��˵������������δ�ﵽƽ������.
���Դ��ǣ��������ݱ�����ʱδ�ﵽƽ�⣬��ͬ�Ĵ����Է�Ӧ��Ĵ�������ͬ������ٸ�ʱ���¶Լ״�ѡ������Ӱ�죻
��4���ӱ������ݷ������ڴ���Cat.2�������£��״���ѡ���Ը���˵������Cat.2�Է�Ӧ���Ч�����ã������ܽ��ͷ�Ӧ�Ļ�ܣ�˵��ʹ�ô���Cat.2�ķ�Ӧ�����л�ܸ��ͣ����Դ��ǣ� 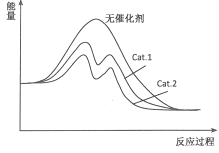 ��
��
��5��CO2Ҳ��������ˮ��Һ��ͨ��������ɼ״���CԪ�ػ��ϼ۽��ͣ�����ԭ��ӦΪ���ص�������Ӧ��
���Դ��ǣ�����CO2+6H++6e��=CH3OH+H2O��
�����㾫����������Ĺؼ��������⻯ѧƽ��״̬���ʼ����������֪ʶ�����ջ�ѧƽ��״̬�����������ȡ��� V��=V��>0�����������Ƕ�̬ƽ�⣬ƽ��ʱ��Ӧ���ڽ��У�����������Ӧ������и���ְٷֺ������䣻���䡱�������ı䣬ƽ�ⱻ���ƣ������µ������½����µĻ�ѧƽ�⣻��;���أ�����������䣬���淴Ӧ�����Ǵ�����Ӧ��ʼ�����Ǵ��淴Ӧ��ʼ�����ɽ���ͬһƽ��״̬����Ч�����Լ��Ի�ѧƽ��ļ�������⣬�˽ⷴӦ��ת����=ת��Ũ�ȡ���ʼŨ�ȡ�100%=ת�����ʵ�������ʼ���ʵ�����100%����Ʒ�IJ���=ʵ�����ɲ�������ʵ����������Ͽɵõ���������ʵ�����100%��

 ��˼ά������ҵ���ټ��ִ�ѧ������ϵ�д�
��˼ά������ҵ���ټ��ִ�ѧ������ϵ�д�