题目内容
下表为元素周期表的一部分,读图后请完成下列填空:
(1)上述元素中,非金属性最强的元素是 (填元素符号),它位于元素周期表中第 周期第 族.
(2)用电子式表示Y2W的形成过程: .
(3)写出实验室制取R的最简单气态氢化物的化学方程式 .
(4)Z的单质与氧化铁粉末的混合物称为 ,它们在高温下反应的化学方程式为 .
(5)元素W与M相比,M的非金属性较强,下列叙述中能证明这一事实的是 (填序号).
①常温下W的单质和M的单质状态不同
②M的气态氢化物比W的稳定
③一定条件下W和M的单质都能与氢氧化钠溶液反应
④W的氧化物对应水化物比M的氧化物对应水化物酸性弱.
| ⅠA | 0 | |||||||
| 一 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
| 二 | R | X | ||||||
| 三 | Y | Z | W | M |
(2)用电子式表示Y2W的形成过程:
(3)写出实验室制取R的最简单气态氢化物的化学方程式
(4)Z的单质与氧化铁粉末的混合物称为
(5)元素W与M相比,M的非金属性较强,下列叙述中能证明这一事实的是
①常温下W的单质和M的单质状态不同
②M的气态氢化物比W的稳定
③一定条件下W和M的单质都能与氢氧化钠溶液反应
④W的氧化物对应水化物比M的氧化物对应水化物酸性弱.
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:由元素在周期表中的位置可知,R为氮、X为氟、Y为Na、Z为Al、W为硫、M为Cl.
(1)同周期自左而右非金属性增强,同主族自上而下非金属性减弱(稀有气体除外);
(2)Na2S为离子化合物,由钠离子与硫离子构成,用Na原子、S原子电子式表示其形成过程;
(3)实验室用氯化铵与氢氧化钙在加热条件下制备氨气;
(4)Al与氧化铁混合物称为铝热剂,二者在高温条件下反应生成铁与氧化铝;
(5)可以根据单质与氢气反应难易程度及剧烈程度、氢化物稳定性、最高价含氧酸的酸性强弱等判断元素非金属性.
(1)同周期自左而右非金属性增强,同主族自上而下非金属性减弱(稀有气体除外);
(2)Na2S为离子化合物,由钠离子与硫离子构成,用Na原子、S原子电子式表示其形成过程;
(3)实验室用氯化铵与氢氧化钙在加热条件下制备氨气;
(4)Al与氧化铁混合物称为铝热剂,二者在高温条件下反应生成铁与氧化铝;
(5)可以根据单质与氢气反应难易程度及剧烈程度、氢化物稳定性、最高价含氧酸的酸性强弱等判断元素非金属性.
解答:
解:由元素在周期表中的位置可知,R为氮、X为氟、Y为Na、Z为Al、W为硫、M为Cl.
(1)同周期自左而右非金属性增强,同主族自上而下非金属性减弱(稀有气体除外),故上述元素中非金属性最强的元素为F,处于第二周期ⅦA族,故答案为:F;二、ⅦA;
(2)Na2S为离子化合物,由钠离子与硫离子构成,用Na原子、S原子电子式表示其形成过程为: ,
,
故答案为: ;
;
(3)氯化铵与氢氧化钙在加热条件下反应生成氯化钙、氨气与水,反应方程式为:Ca(OH)2+2NH4Cl
CaCl2+2NH3↑+2H2O,
故答案为:Ca(OH)2+2NH4Cl
CaCl2+2NH3↑+2H2O;
(4)Al与氧化铁混合物称为铝热剂,二者在高温条件下反应生成铁与氧化铝,反应方程式为:2Al+Fe2O3
2Fe+Al2O3,
故答案为:2Al+Fe2O3
2Fe+Al2O3;
(5)可以根据单质与氢气反应难易程度及剧烈程度、氢化物稳定性、最高价含氧酸的酸性强弱等判断元素非金属性,单质的状态属于物理性质,不能比较元素非金属性强弱,单质与碱溶液反应也不能比较非金属性强弱,故①③错误,②④正确,
故答案为:②④.
(1)同周期自左而右非金属性增强,同主族自上而下非金属性减弱(稀有气体除外),故上述元素中非金属性最强的元素为F,处于第二周期ⅦA族,故答案为:F;二、ⅦA;
(2)Na2S为离子化合物,由钠离子与硫离子构成,用Na原子、S原子电子式表示其形成过程为:
 ,
,故答案为:
 ;
;(3)氯化铵与氢氧化钙在加热条件下反应生成氯化钙、氨气与水,反应方程式为:Ca(OH)2+2NH4Cl
| ||
故答案为:Ca(OH)2+2NH4Cl
| ||
(4)Al与氧化铁混合物称为铝热剂,二者在高温条件下反应生成铁与氧化铝,反应方程式为:2Al+Fe2O3
| ||
故答案为:2Al+Fe2O3
| ||
(5)可以根据单质与氢气反应难易程度及剧烈程度、氢化物稳定性、最高价含氧酸的酸性强弱等判断元素非金属性,单质的状态属于物理性质,不能比较元素非金属性强弱,单质与碱溶液反应也不能比较非金属性强弱,故①③错误,②④正确,
故答案为:②④.
点评:本题考查元素周期表与元素周期律综合应用,难度不大,注意整体把握元素周期表结构,掌握用电子式表示物质的形成或化学键形成.

练习册系列答案
相关题目
A、B是短周期ⅤⅡA族的两种元素,A的非金属性比B强.下列关于A、B的说法正确的是( )
| A、A元素的单质可以把B元素的单质从NaB溶液中置换出来 |
| B、NaA、NaB的晶体都是离子晶体,且NaA晶体的熔点比NaB高 |
| C、HA的沸点比HB高,是因为1mol HA分子中H-A键断裂时吸附的能量比1mol HB分子中H-B键断裂时吸收的能量多 |
| D、常温下,NaA、NaB溶液的pH均大于7 |
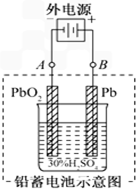 铅蓄电池是典型的可充电型电池,它的正负极格板是惰性材料,电池总反应式为:
铅蓄电池是典型的可充电型电池,它的正负极格板是惰性材料,电池总反应式为:Pb+PbO2+4H++2SO42-
| 放电 |
| 充电 |
| A、放电时:电解液中H2SO4的浓度将变小;正极的电极反应式是PbO2+2e-+4H++SO42-=PbSO4+2H2O |
| B、当外电路通过1mol电子时,理论上负极板的质量增加48g,正极板的质量增加32g |
| C、电池在完全放电耗尽PbO2和Pb时,若按图连接,电解一段时间后,则在A电极上生成PbO2、B电极上生成Pb |
| D、若按图连接,电解一段时间后,此时铅蓄电池的电极的极性将对换 |