��Ŀ����
����Ŀ����ͼ��ʾ��Zn��Cu�γɵ�ԭ��أ�ijʵ����ȤС������ʵ����ڶ��鿨�ϵļ�¼���£���Ƭ�������������ǣ� ��

��Cu������Zn����
��Cu���������ݲ�����������ԭ��Ӧ
��SO42-��Cu���ƶ�
������0.5mol�����������ߣ���ɲ���0.25mol����
�ݵ��ӵ������ǣ�Cu��Zn
��������Ӧʽ��Cu+2e-=Cu2+������������Ӧ��
A.�٢ڢ�B.�ڢܢ�C.�ۢܢ�D.�ڢ�
���𰸡�D
��������
Zn-Cuԭ����У�Zn ��������Cu��������������ط�ӦZn+2H+=Zn2++H2���������ɸ��������������������������ƶ����ݴ˷������н��
��Zn����ʧ����Ϊ������CuΪ�������ٴ���
��Cu���������ӵõ��ӷ�����ԭ��Ӧ������Cu�������ݲ���������ȷ��
����Һ�����������ƶ�����SO42-��Zn���ƶ����۴���
��CuΪ�����������Ϸ�����Ӧ2H++2e-=H2������0.5mol�����������ߣ���ɲ���0.25mol���壬����ȷ��
�ݵ����ɸ������������������ӵ������ǣ�Zn��Cu���ݴ���
��CuΪ�����������Ϸ�����Ӧ2H++2e-=H2�����õ������ǻ�ԭ��Ӧ������
��ѡD��

����Ŀ����Ԫ�����������õ�������ѧ���ʣ����㷺Ӧ�������������С��Ӻ��ܷ���(��CoO��Co2O3������Al��Li��)����ȡ��CoCl2��6H2O������������ʾ��
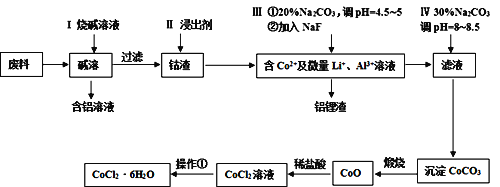
��ش��������⣺
(1)����I����Ҫ�����Ļ�ѧ��Ӧ����ʽΪ______��
(2)��֪Co2O3����ǿ�����ԣ�������II�н�����Ϊ���ᣬ��ɵĺ����_______��
(3)�������Тٵ�Ŀ���dz�ȥAl3+��д���ò���Ӧ�����ӷ���ʽ______��
(4)����ʵ��������CoCO3������Ĺ��������������ƾ��ƺͲ������⣬����______��______(����������)��
(5)����������HCl��Χ�н��еģ��䲽����______��_____�����ˡ�ϴ�ӡ����ϴ�ӹ����п����ù�ҵ�ƾ�����ˮ�����ŵ���_____��
(6)ijͬѧ�ñ���������Һ�ζ�δ֪Ũ�ȵ�CoCl2��Һ�����п���Ϊָʾ������____(��ѡ������������ӵ���ɫ����)
A��KCl B��KSCN C��K2CrO4 D��K2S
��֪����������20��ʱ����ɫ��Kspֵ���±�
��ѧʽ | AgCl | AgSCN | Ag2S | Ag2CrO4 |
��ɫ | ��ɫ | dz��ɫ | ��ɫ | ��ɫ |
Ksp | 2.0��10-10 | 1.0��10-12 | 2.0��10-48 | 2.0��10-12 |



