题目内容
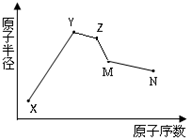 (2012?门头沟区一模)X、Y、Z、M、N五种常见的短周期元素原子半径随原子序数变化如图.已知X的一种原子的质量数为18,中子数为10;Y和Ne原子的核外电子数相差1;M的单质是一种常见的半导体材料;N的原子半径在同周期主族元素中最小;Y、Z、N三种元素的最高氧化物对应的水化物两两之间可以发生反应.下列说法错误的是( )
(2012?门头沟区一模)X、Y、Z、M、N五种常见的短周期元素原子半径随原子序数变化如图.已知X的一种原子的质量数为18,中子数为10;Y和Ne原子的核外电子数相差1;M的单质是一种常见的半导体材料;N的原子半径在同周期主族元素中最小;Y、Z、N三种元素的最高氧化物对应的水化物两两之间可以发生反应.下列说法错误的是( )分析:X的一种原子的质量数为18,中子数为10,则质子数为18-10=8,应为O元素,Y和Ne原子的核外电子数相差1,且原子半径大于X,应为Na元素,M的单质,是一种常见的半导体材料,应为Si,N的原子半径在同周期主族元素中最小,应为Cl元素,Y、Z、N三种元素的最高氧化物对应的水化物两两之间可以发生反应,则Z为Al,结合元素对应单质、化合物的性质以及元素周期律的递变规律解答该题.
解答:解:X的一种原子的质量数为18,中子数为10,则质子数为18-10=8,应为O元素,Y和Ne原子的核外电子数相差1,且原子半径大于X,应为Na元素,M的单质,是一种常见的半导体材料,应为Si,N的原子半径在同周期主族元素中最小,应为Cl元素,Y、Z、N三种元素的最高氧化物对应的水化物两两之间可以发生反应,则Z为Al,
A.Cl-比Al3+多一个电子层,离子半径较大,故A正确;
B.非金属性Si<Cl,元素的非金属性越强,对应的氢化物越稳定,故B正确;
C.X与Y两种元素组成的化合物分别为Na2O、Na2O2,阴、阳离子的个数比为1:2,故C错误;
D.工业常用电解NaCl的方法冶炼Na,故D正确.
故选C.
A.Cl-比Al3+多一个电子层,离子半径较大,故A正确;
B.非金属性Si<Cl,元素的非金属性越强,对应的氢化物越稳定,故B正确;
C.X与Y两种元素组成的化合物分别为Na2O、Na2O2,阴、阳离子的个数比为1:2,故C错误;
D.工业常用电解NaCl的方法冶炼Na,故D正确.
故选C.
点评:本题考查原子结构与元素周期律的关系,题目难度中等,注意把握元素周期律的递变规律以及原子核外电子的排布特点,明确元素的种类为解答该题的关键.

练习册系列答案
相关题目
