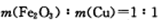题目内容
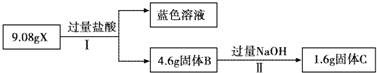
某混合物X由Al2O3、Fe2O3、Cu、SiO2中的一种或几种物质组成.进行如实验:下列有关说法正确的是( )


| A、步骤I中减少的3g固体一定是混合物 | B、步骤II中质量减少的物质一定是Cu | C、根据步骤I、II可以判断混合物X的成分为Al2O3、Fe2O3、Cu、SiO2 | D、根据上述步骤II可以得出m(Fe2O3):m(Cu)=1:1 |
分析:9.4gX与过量的氢氧化钠溶液反应后得到6.4g不溶物,固体部分溶解,原固体中至少含有Al2O3、SiO2的一种物质;6.4g固体与过量的盐酸反应得到蓝色溶液,蓝色溶液中存在铜离子,发生了反应:Fe2O3+6H+═2Fe3++3H2O;Cu+2Fe3+═2Fe2++Cu2+,说明溶液中一定存在Fe2O3,1.92g固体为铜,据此进行判断.
解答:解:A、Al2O3、SiO2都能够与NaOH溶液反应,所以步骤I中减少的3g固体可能为氧化铝或二氧化硅,不一定为混合物,故A错误;
B、步骤II中发生了反应:Fe2O3+6H+═2Fe3++3H2O;Cu+2Fe3+═2Fe2++Cu2+,6.4g固体为铜和Fe2O3的混合物,减少的为铜和氧化铁,故B错误;
C、根据步骤I只能判断混合物中至少含有Al2O3、SiO2的一种物质,无法确定Al2O3、SiO2是否都存在;步骤II可以确定一定存在Fe2O3、Cu,故C错误;
D、6.4g变成1.92g,质量减少了:6.4g-1.92g=4.48g,减少的质量为Fe2O3和部分Cu,剩余的1.92g为铜,设铜的物质的量为x,根据反应Cu+2Fe3+═2Fe2++Cu2+可知氧化铁的物质的量也为x,则64x+160x=4.48,解得x=0.02mol,则m(Fe2O3):m(Cu)=(160×0.02):(64×0.02+1.92)=1:1,故D正确;
故选D.
B、步骤II中发生了反应:Fe2O3+6H+═2Fe3++3H2O;Cu+2Fe3+═2Fe2++Cu2+,6.4g固体为铜和Fe2O3的混合物,减少的为铜和氧化铁,故B错误;
C、根据步骤I只能判断混合物中至少含有Al2O3、SiO2的一种物质,无法确定Al2O3、SiO2是否都存在;步骤II可以确定一定存在Fe2O3、Cu,故C错误;
D、6.4g变成1.92g,质量减少了:6.4g-1.92g=4.48g,减少的质量为Fe2O3和部分Cu,剩余的1.92g为铜,设铜的物质的量为x,根据反应Cu+2Fe3+═2Fe2++Cu2+可知氧化铁的物质的量也为x,则64x+160x=4.48,解得x=0.02mol,则m(Fe2O3):m(Cu)=(160×0.02):(64×0.02+1.92)=1:1,故D正确;
故选D.
点评:本题考查了未知物的检验、有关化学反应的简单计算,题目难度中等,注意掌握检验未知物的采用方法,能够根据反应现象判断存在的物质,选项D为难点和易错点,注意合理分析题中数据,根据题中数据及反应方程式计算出铜和氧化铁的质量.

练习册系列答案
相关题目
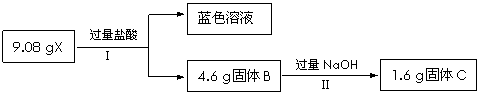
某混合物X由Al2O3、Fe2O3、Cu、SiO2中的一种或几种物质组成。进行如下实验。
 |
试回答:
(1)经I得到蓝色溶液,该过程中一定发生的化学反应是(用离子方程式表示)
、 。
(2)X中一定含有的物质是 。反应II的化学方程式是 。
(3)为进一步确定上述混合物X的成分,另取9.08 g X进行如下实验。
① 加入足量的NaOH溶液,过滤,将滤渣在氮气气流中干燥得固体m g。
② 向滤渣中加入过量盐酸,过滤,将滤渣在氮气气流中干燥得固体n g。
由于缺少某步操作,使得测定的质量m、n均偏高。
③ 按正确步骤重新进行实验后得到m=6.08 g,n=1.6 g。
则所缺少的步骤是______。原混合物中各成分的质量之比是 。(不必化简)