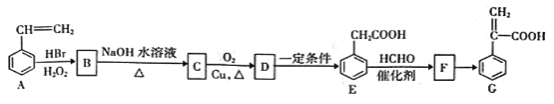
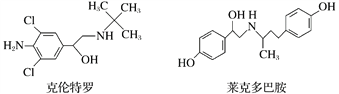
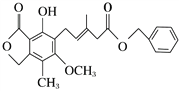
题目内容
【题目】根据物质的组成和性质将下列无机化合物进行了分类。
物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
化学式 | ①H2SO4 ②H2CO3 | ③NaOH ④Ba(OH)2 | ⑤NaHSO4 ⑥_________ | ⑦SO2 ⑧Na2O | ⑨HCl ⑩__________ |
(1)请仔细观察表格中的物质类别,从H、O、C、N四种元素中任选两种或三种组成合适的物质,将化学式分别填在表中⑥、⑩后面的横线上(各写一种)。
(2)写出①和④反应的离子方程式:___________________________________________。
(3)⑦与CO2都属于酸性氧化物,写出少量⑦通入③的溶液中反应的离子方程式_____________。
(4)①和⑤都易溶于水并电离出SO![]() ,检验溶液中SO
,检验溶液中SO![]() 的方法是____________________。
的方法是____________________。
【答案】 NH4NO3 NH3 Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O 2OH-+SO2 = SO32-+H2O 取少量待测液于试管中,先加入稀盐酸,无明显现象,再加入BaCl2溶液,若出现白色沉淀说明溶液中存在SO42-
【解析】(1)⑥属于盐类,⑩属于氢化物,H、O、C、N四种元素能组成的盐可以是NH4NO3,能组成的氢化物是NH3;(2)①和④反应生成硫酸钡和水,反应的离子方程式为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O;(3)⑦少量SO2通入氢氧化钠溶液中生成亚硫酸钠和水,反应的离子方程式为2OH-+SO2=SO32-+H2O。(4)硫酸钡不溶于水,也不溶于酸,检验硫酸根的方法是取少量待测液于试管中,先加入稀盐酸,无明显现象,再加入BaCl2溶液,若出现白色沉淀说明溶液中存在SO42-。

【题目】某学生在实验室制取乙酸乙酯的主要步骤如下:①在大试管A中配制反应混合液;②按图甲所示连接好装置(装置气密性良好),用小火均匀加热大试管A 5~10 min;③待试管B收集到一定量产物后停止加热,撤去导管并用力振荡,然后静置,待分层;④分离出乙酸乙酯层,洗涤、干燥。

已知:乙醇可以和氯化钙反应,生成微溶于水的CaCl2·6C2H5OH;无水硫酸钠易吸水形成硫酸钠结晶水合物。
有关试剂的部分数据如下:
物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 |
乙醇 | -117.3 | 78.5 | 0.789 |
乙酸 | 16.6 | 117.9 | 1.05 |
乙酸乙酯 | -83.6 | 77.5 | 0.90 |
浓硫酸(98%) |
| 338.0 | 1.84 |
(1)配制反应混合液的主要操作步骤为_______________________(不必指出液体体积);制取乙酸乙酯的化学方程式为________________。
(2)上述实验中饱和Na2CO3溶液的作用是________(填字母)。
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.减小乙酸乙酯的溶解度,有利于其分层析出
D.加速乙酸乙酯的生成,提高其产率
(3)步骤②中需要小火均匀加热,其主要原因之一是温度过高会发生副反应,另一个原因是________________________________________________________。
(4)写出步骤③中观察到的现象___________________________。
(5)分离出乙酸乙酯层后,一般用饱和CaCl2溶液洗涤。通过洗涤可除去的杂质是________(填名称);干燥乙酸乙酯可选用的干燥剂为________(填字母)。
A.P2O5 B.无水硫酸钠
C.碱石灰 D.NaOH固体
(6)某化学课外小组设计了图乙所示的制取乙酸乙酯的装置(图中铁架台、铁夹、加热装置均已略去),与图甲装置相比,图乙装置的主要优点有________(填字母)。

a.增加了温度计,有利于控制反应温度
b.增加了分液漏斗,能随时补充反应混合液,减少反应物蒸发
c.增加了冷凝装置,有利于收集产物
d.反应容器容积大,容纳反应物的量多